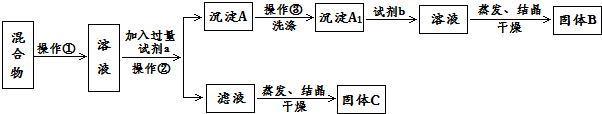
题目内容
2.将16g两种金属的混合物投入足量稀硫酸中,反应完全后得到H2 8.96L(标准状况),则该混合物的组成可能是( )| A. | 钠和铁 | B. | 镁和铜 | C. | 铝和镁 | D. | 锌和铁 |
分析 假设金属均为+2价,金属总物质的量等于氢气物质的量,根据n=$\frac{m}{M}$计算混合金属平均摩尔质量;因为为两种金属的混合物,故平均摩尔质量应介于各组分之间,根据电子转移守恒,若金属不与盐酸反应,其摩尔质量可以视作无穷大;Al为+2价时的摩尔质量为:$\frac{27g/mol}{3}$×2=18g/mol.
解答 解:标况下8.96L氢气物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,
假设金属均为+2价,金属总物质的量等于氢气物质的量,
故混合金属平均摩尔质量为:$\frac{16g}{0.4mol}$=40g/mol,因为为两种金属的混合物,故该平均摩尔质量应介于各组分之间,
A.Na为+1价金属,转化为+2价金属的摩尔质量为46g/mol,铁的摩尔质量为56g/mol,二者的平均摩尔质量一定大于40g/mol,故A错误;
B.Cu不与盐酸反应,其摩尔质量可以视作无穷大;镁的摩尔质量为24g/mol,二者的平均摩尔质量可以为40g/mol,故B正确;
C.Mg的摩尔质量为24g/mol,Al为+2价时的摩尔质量为:$\frac{27g/mol}{3}$×2=18g/mol,二者的摩尔质量都小于40g/mol,故C错误;
D.锌的摩尔质量为65g/mol,Fe的摩尔质量为56g/mol,二者摩尔质量都大于30/mol,不符合题意,故D错误;
故选B.
点评 本题考查混合物反应的计算,题目难度中等,注意明确金属与酸反应的实质,熟练掌握平均摩尔质量在化学计算中的应用方法,试题充分考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
12.下列装置中,能对Fe片腐蚀起防护作用的是( )

| A. | ③④ | B. | ②⑤ | C. | ①③④ | D. | ②③④⑤ |
13.青蒿素结构式如图所示.下列有关青蒿素的说法错误的是( )
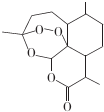

| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素可溶于NaOH溶液,可使酸性高锰酸钾溶液褪色 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
10.一种微生物燃料电池工作原理示意图如下,微生物膜中的酶作催化剂.下列叙述不正确的是( )

| A. | 电池工作时,既能净化废水,又能发电 | |
| B. | X电极为负极,工作时发生氧化反应 | |
| C. | 正极反应式为2NO3-+10e-+6H2O═N2↑+12OH- | |
| D. | 该电池在常温和高温时都可以工作 |
17.分类是重要的科学研究方法,下列物质归类正确的是( )
| A. | 碱:苛性钠、纯碱、熟石灰 | |
| B. | 碱性氧化物:氧化铜、七氧化二锰、氧化铝 | |
| C. | 盐:胆矾、小苏打、铜绿 | |
| D. | 无丁达尔现象的分散系:碘的四氯化碳溶液、淀粉溶液、氯化铁溶液 |
7.对于反应H-+NH3═H2+NH2-的正确说法是( )
| A. | 属于置换反应 | B. | H-是氧化剂 | ||
| C. | NH3是还原剂 | D. | 氧化产物和还原产物都是H2 |
11.钢铁、铝合金、铜合金这三种合金具有广泛的用途下列说法正确的是( )
| A. | 碳钢与生铁主要成分相同,所以性能相同 | |
| B. | 镁铝合金可用于制造飞机、汽车等部件 | |
| C. | 铜合金具有优异的导电、导热性能,但耐腐蚀性能力较差 | |
| D. | 铝铁合金具有很高的熔点,能用于制造火箭外层材料. |