题目内容
17.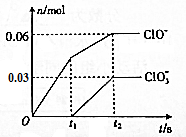 将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )| A. | 3:7 | B. | 7:3 | C. | 3:2 | D. | 2:3 |
分析 由图可知,t2时刻生成ClO-和ClO3-的物质的量分别为0.06mol、0.03mol,失去电子为0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,则得到电子应为0.21mol,结合电子守恒计算.
解答 解:由图可知,t2时刻生成ClO-和ClO3-的物质的量分别为0.06mol、0.03mol,失去电子为0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,
由电子守恒可知得到电子应为0.21mol,则Cl-的物质的量为$\frac{0.21mol}{[0-(-1)]}$=0.21mol,
氧化产物为NaClO和NaClO3,还原产物为NaCl,则t2时刻,n(还原产物):n(氧化产物)为0.21mol:0.09mol=7:3,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
7.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列实验现象和结论一致且正确的是( )
| A. | 加入有色布条,有色布条褪色,说明溶液中有氯气分子存在 | |
| B. | 溶液呈现黄绿色,且有刺激性气味,说明有氯气分子存在 | |
| C. | 先加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明有Cl-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
8.下列各组混合物的分离或提纯方法不正确的是( )
| A. | 用溶解、过滤的方法出去CaO中的CaCO3杂质 | |
| B. | 用结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| C. | 用蒸馏法分离乙醇和乙酸(沸点分别为78℃、118℃)的混合物 | |
| D. | 用萃取和分液的方法可以分离碘和水的混合物 |
3.目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点.
(1)将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,配平下列离子方程式:
2Fe(OH)3+3ClO-+OH-═2FeO42-+3Cl-+5H2O
(2)用Fe做阳极,Cu做阴极,NaOH溶液做电解液,用电解的方法也可制得Na2FeO4,则电解过程中阳极的反应式为Fe+8OH--6e-=FeO42-+4H2O.
(3)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2•7H20,过程如下:
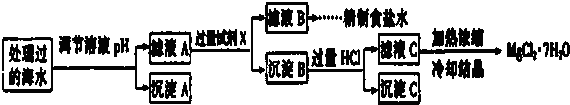
注:离子浓度小于10-5mol/L 可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=1.0×10-12;操作过程中溶液体积的变化忽略不计.
①表格中的a>0.16 (填“<”或“=”或“>”).
②沉淀A的组成为Fe(OH)3(填化学式);在调节溶液pH时,理论上应调节的pH的范围是3≤pH<9.
③加入的过量试剂X为Ba(OH)2 (填化学式).
④加入过量HCl的作用为使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解.
(1)将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,配平下列离子方程式:
2Fe(OH)3+3ClO-+OH-═2FeO42-+3Cl-+5H2O
(2)用Fe做阳极,Cu做阴极,NaOH溶液做电解液,用电解的方法也可制得Na2FeO4,则电解过程中阳极的反应式为Fe+8OH--6e-=FeO42-+4H2O.
(3)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |

注:离子浓度小于10-5mol/L 可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=1.0×10-12;操作过程中溶液体积的变化忽略不计.
①表格中的a>0.16 (填“<”或“=”或“>”).
②沉淀A的组成为Fe(OH)3(填化学式);在调节溶液pH时,理论上应调节的pH的范围是3≤pH<9.
③加入的过量试剂X为Ba(OH)2 (填化学式).
④加入过量HCl的作用为使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解.

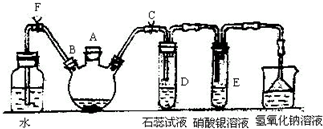 实验室制备溴苯可用如图所示的装置,填写下列空白:
实验室制备溴苯可用如图所示的装置,填写下列空白: .
.