题目内容
12.如图1将各烧杯用导线串联,外接电源和灯泡,发现灯泡不亮,向其中一个烧杯中加水后,灯泡变亮.回答下列问题:(1)写出A烧杯中电解质的电离方程式:H2SO4=2H++SO42-.
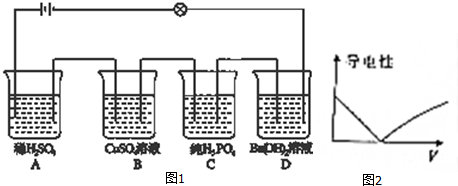
(2)四个烧杯中的分散质,其中属于盐的是CuSO4(写化学式)
(3)加水的烧杯为C(填字母,下同).
(4)烧杯B中的溶液和烧杯D中的溶液混合后,溶液的导电性如图2所示,该混合过程中反应的离子方程式为Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓.
分析 如图1将各烧杯用导线串联,外接电源和灯泡,发现灯泡不亮,是由于磷酸是共价化合物,在熔融状态不能电离,故不导电,向其中一个烧杯中加水后,灯泡变亮,故加水的烧杯为盛装磷酸的烧杯.
(1)硫酸是强电解质,在溶液中能完全电离;
(2)盐是阴离子是酸根离子,阳离子是金属离子或铵根离子的化合物;
(3)根据磷酸是共价化合物,在熔融状态不能电离来分析;
(4)CuSO4和Ba(OH)2反应生成硫酸钡沉淀和氢氧化铜沉淀.
解答 解:如图1将各烧杯用导线串联,外接电源和灯泡,发现灯泡不亮,是由于磷酸是共价化合物,在熔融状态不能电离,故不导电,向其中一个烧杯中加水后,灯泡变亮,故加水的烧杯为盛装磷酸的烧杯.
(1)硫酸是强电解质,在溶液中能完全电离,故电离方程式为:H2SO4=2H++SO42-,故答案为:H2SO4=2H++SO42-;
(2)盐是阴离子是酸根离子,阳离子是金属离子或铵根离子的化合物,故CuSO4属于盐,故答案为:CuSO4;
(3)外接电源和灯泡,发现灯泡不亮,是由于磷酸是共价化合物,在熔融状态不能电离,故不导电,向其中一个烧杯中加水后,灯泡变亮,故加水的烧杯为盛装磷酸的烧杯,故答案为:C;
(4)CuSO4和Ba(OH)2反应生成硫酸钡沉淀和氢氧化铜沉淀,离子方程式为Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓,故答案为:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓.
点评 本题考查了溶液导电的原因和共价键的特点,应注意的是共价键在熔融状态下不导电,在水溶液中可能导电,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.有关甲苯的实验事实中,能说明苯环对侧链性质的影响的是( )
| A. | 甲苯和硝酸反应生成三硝基甲苯 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol甲苯能与3mol氢气发生加成反应 | |
| D. | 甲苯可以燃烧并产生浓烈的黑烟 |
7.下列各表述与示意图一致的是( )
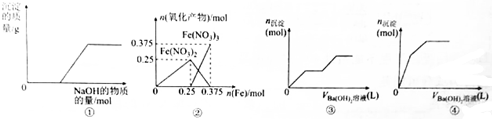

| A. | 图①表示向Ca(HCO3)2溶液中滴加NaOH溶液时,产生沉淀的质量与加入NaOH的物质的量之间的关系 | |
| B. | 图②表示向n(HNO3)=1mol的稀HNO3中加入Fe时,氧化产物(还原产物为NO)的物质的量与Fe的物质的量之间的关系 | |
| C. | 图③可用来表示向含有4mol HCl和1mol MgSO4的混合溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系 | |
| D. | 图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系 |
17.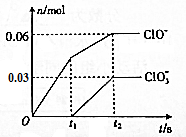 将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
 将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )| A. | 3:7 | B. | 7:3 | C. | 3:2 | D. | 2:3 |
4.已知①Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓②Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$NaSiO3+CO2↑ 下列有关说法不正确是( )
| A. | 反应①是熵减小的反应,而反应②是熵增大的反应 | |
| B. | 反应②高温时能自发迸行.是由于生成CO2使熵值增大 | |
| C. | 上述事实说明的H2SiO3酸性有时比H2CO3强,有时比H2CO3弱 | |
| D. | H2CO3酸性强于H2SiO3,不能用反应②进行解释 |
