题目内容
8.下列各组混合物的分离或提纯方法不正确的是( )| A. | 用溶解、过滤的方法出去CaO中的CaCO3杂质 | |
| B. | 用结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| C. | 用蒸馏法分离乙醇和乙酸(沸点分别为78℃、118℃)的混合物 | |
| D. | 用萃取和分液的方法可以分离碘和水的混合物 |
分析 A.碳酸钙不溶于水,溶解后CaO转化为氢氧化钙;
B.NaCl和KNO3的溶解度受温度影响不同;
C.乙醇和乙酸互溶,但沸点不同;
D.碘不易溶于水,易溶于有机溶剂.
解答 解:A.碳酸钙不溶于水,溶解后CaO转化为氢氧化钙,不能除杂,应高温加热分解除杂,故A错误;
B.NaCl和KNO3的溶解度受温度影响不同,则用结晶法提纯NaCl和KNO3混合物中的KNO3,故B正确;
C.乙醇和乙酸互溶,但沸点不同,则应选蒸馏法分离,故C正确;
D.碘不易溶于水,易溶于有机溶剂,则利用萃取、分液分离碘和水,故D正确;
故选A.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意有机物的性质,题目难度不大.

练习册系列答案
相关题目
18.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中不正确的是( )
| A. | Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间 | |
| B. | 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 | |
| C. | 三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性 | |
| D. | 三种分散系中分散质均属于电解质 |
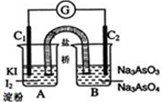 将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:
将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:
 .
. +C2H5OH$?_{△}^{浓硫酸}$
+C2H5OH$?_{△}^{浓硫酸}$ +H2O.
+H2O. +CH2I→
+CH2I→ +HI.
+HI. 的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有19种.
的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有19种. 将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
