题目内容
已知:常温下,0.01mol?L-1 BOH溶液的pH为11,BOH(aq)与H2SO4(aq)反应生成1mol正盐的△H=-26.4kJ?mol-1.则BOH在水溶液中电离的△H为( )
| A、-70.5 kJ?mol-1 |
| B、-44.1 kJ?mol-1 |
| C、70.5 kJ?mol-1 |
| D、44.1 kJ?mol-1 |
考点:水的电离
专题:
分析:由题意知BOH是弱碱:BOH(aq)+H+(aq)═B+(aq)+H2O(l)△H1=-13.2 kJ?mol-1①,H+(aq)+OH-(aq)═H2O(l)△H2=-57.3 kJ?mol-1②,根据盖斯定律构造BOH(aq)??B+(aq)+OH-(aq)并计算焓变.
解答:
解:常温下,0.01mol?L-1 BOH溶液的pH为11,说明BOH是弱碱:BOH(aq)+H+(aq)═B+(aq)+H2O(l)△H1=-13.2 kJ?mol-1①,
H+(aq)+OH-(aq)═H2O(l)△H2=-57.3 kJ?mol-1②,
根据盖斯定律,由①-②得:BOH(aq)?B+(aq)+OH-(aq)△H=(-13.2+57.3)kJ?mol-1=+44.1kJ?mol-1,
故选:D.
H+(aq)+OH-(aq)═H2O(l)△H2=-57.3 kJ?mol-1②,
根据盖斯定律,由①-②得:BOH(aq)?B+(aq)+OH-(aq)△H=(-13.2+57.3)kJ?mol-1=+44.1kJ?mol-1,
故选:D.
点评:本题考查了弱电解质的判断和反应热的计算,综合性较强,注意弱电解质的判断和利用盖斯定律进行构造目标热化学方程式并计算焓变是解题的关键题目难度中等.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
高温下,某反应达平衡,平衡常数K═
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应的焓变为正值 | ||||
| B、恒温恒容下,增大压强,H2浓度一定减小催化剂高温 | ||||
| C、升高温度,逆反应速率减小 | ||||
D、该反应的化学方程式为CO+H2O
|
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+.Ag+.Na+.Cl- |
| B、K+.Na+.NO3-.CO32- |
| C、Na+.H+.NO3-.SO42- |
| D、Fe3+.Na+.Cl-. SO42- |
下列离子方程式中正确的是( )
| A、向稀硫酸溶液中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |
| B、向NaOH溶液中加入醋酸:H++OH-═H2O |
| C、向硝酸银溶液中加入盐酸:Ag++Cl-═AgCl↓ |
| D、向氢氧化钡溶液中加入硫酸铜溶液:Ba2++SO42-═BaSO4↓ |

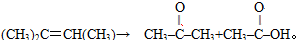 现有1mol某烯烃分子被酸性高锰酸钾溶液氧化后得到2molCO2,和
现有1mol某烯烃分子被酸性高锰酸钾溶液氧化后得到2molCO2,和 请写出该烯烃分子发生加聚反应的化学方程式
请写出该烯烃分子发生加聚反应的化学方程式