题目内容
高温下,某反应达平衡,平衡常数K═
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应的焓变为正值 | ||||
| B、恒温恒容下,增大压强,H2浓度一定减小催化剂高温 | ||||
| C、升高温度,逆反应速率减小 | ||||
D、该反应的化学方程式为CO+H2O
|
考点:化学平衡的影响因素
专题:
分析:高温下,某反应达平衡,平衡常数K=
,该反应为CO2+H2?CO+H2O,恒容时,温度升高,H2浓度减小,则该反应为吸热反应,以此来解答.
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
解答:
解:A、恒容时,温度升高,H2浓度减小,则该反应为吸热反应,所以△H>0,故A正确;
B、恒温恒容下,增大压强,若通入氢气,则H2浓度增大,故B错误;
C.升高温度,正逆反应速率都增大,故C错误;
D.由平衡常数可知,该反应为CO2+H2?CO+H2O,故D错误;
故选A.
B、恒温恒容下,增大压强,若通入氢气,则H2浓度增大,故B错误;
C.升高温度,正逆反应速率都增大,故C错误;
D.由平衡常数可知,该反应为CO2+H2?CO+H2O,故D错误;
故选A.
点评:本题考查影响化学平衡的因素,明确平衡常数与化学反应的关系及温度对化学平衡的影响即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
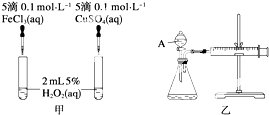 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A、图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B、若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C、用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| D、为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
把3.0mol M和2.5mol N混合于2.0L的恒容密闭容器中,发生反应3M(g)+N(g)?xP(g)+2Q(g),5min反应达到平衡,已知M的转化率为50%,P的反应速率为0.15mol?L-1?min-1,则下列说法正确的是( )
| A、方程式中x=2 |
| B、达平衡后,容器内压强是反应起始时的2倍 |
| C、向容器中再充入3.0 mol M和2.5 mol N,达新平衡时Q的体积分数减小 |
| D、容器内混合气体的密度不再变化和平均相对分子质量不再变化均可作为达到平衡状态的标志 |
有关青霉素的说法中不正确的是( )
| A、青霉素G是一种良效广谱抗生素 |
| B、青霉素的结构骨干中均有青霉酸 |
| C、青霉素最初是在青酶的培养液中取得的 |
| D、青霉素在使用前不需要做皮肤敏感实验 |
下列各组物质中,肯定是同系物的是( )
| A、甲苯和邻甲基乙苯 |
| B、CH2=CH2和 C6H5-CH=CH2 |
| C、C2H2和C4H6 |
| D、正戊烷和2一甲基丁烷 |
已知:常温下,0.01mol?L-1 BOH溶液的pH为11,BOH(aq)与H2SO4(aq)反应生成1mol正盐的△H=-26.4kJ?mol-1.则BOH在水溶液中电离的△H为( )
| A、-70.5 kJ?mol-1 |
| B、-44.1 kJ?mol-1 |
| C、70.5 kJ?mol-1 |
| D、44.1 kJ?mol-1 |
下列实验推理中,正确的是( )
| A、实验时剩余的药品不能放回原瓶,所以实验时剩余的金属钠也不能放回原瓶 |
| B、某种气体通入品红溶液中,品红褪色,该气体一定是SO2 |
| C、焰色反应时观察到黄色火焰,说明样品中一定含钠元素可能含钾元素 |
| D、将铜片放入浓硫酸中,无明显现象,说明铜在冷浓硫酸中发生钝化 |
“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9 m,其研究成果广泛应用于催化及军事科学中.“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料.如将“纳米材料”分散到蒸馏水中,所得混合物可能具有的性质是( )
| A、该分散系放置一段时间可能很快出现分层现象 |
| B、有丁达尔效应 |
| C、不能透过滤纸 |
| D、所得分散系一定是浊液 |