题目内容
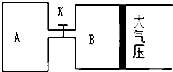 如图所示,当关闭K时,向容器A中充入1molX、1molY,向容器B中充入2molX、2molY,
如图所示,当关闭K时,向容器A中充入1molX、1molY,向容器B中充入2molX、2molY,起始时,容器A、B的体积分别为2L,且两容器之间连通管的体积可忽略不计,在T1温度和催化剂存在的条件下,两容器中各自发生下列反应:2X(g)+2Y(g)→aZ(g)+2W(g)△H<0,达到平衡(I)时,V(B)=1.6L.
请回答:
(1)反应式中的a=
(2)平衡(I)时,A中W和B中W的物质的量比较:n(W)
(3)若T1温度时,容器A中反应的平衡常数为K(A),容器B中反应的平衡常数为K(B),则该温度下,K(A)
(4)若保持反应温度为T1,打开K,过一段时间重新达平衡(Ⅱ)时B的体积为
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)B中加入2molX、2molY,开始气体体积为2L,平衡后V(B)=1.6L,依据气体体积之比等于气体物质的量之比计算得到,气体物质的量减小,4>a+2,a<2,判断a=1,结合平衡三段式列式计算平衡常数=
;
(2)向容器A中充入1molX、1molY,向容器B中充入2molX、2molY,若B体积为2a,则达到平衡状态AB相同,B气体体积为1,6L,说明B中,相当于体积减小压强增大,平衡正向进行,W的物质的量B>A;
(3)平衡常数随温度变化,不随浓度变化;
(4)依据气体体积之比等于气体物质的量之比计算分析.
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
(2)向容器A中充入1molX、1molY,向容器B中充入2molX、2molY,若B体积为2a,则达到平衡状态AB相同,B气体体积为1,6L,说明B中,相当于体积减小压强增大,平衡正向进行,W的物质的量B>A;
(3)平衡常数随温度变化,不随浓度变化;
(4)依据气体体积之比等于气体物质的量之比计算分析.
解答:
解:(1)B中加入2molX、2molY,开始气体体积为2L,平衡后V(B)=1.6L,依据气体体积之比等于气体物质的量之比计算得到,气体物质的量减小,4>a+2,a<2,判断a=1,依据反应前后气体体积比等于气体物质的量之比,2:4=1.6:n(平衡),平衡后气体物质的量为n(平衡)=3.2mol,变化的物质的量和生成Z物质的量相同=4mol-3.2mol=0.8mol,
2X(g)+2Y(g)→Z(g)+2W(g)
起始量(mol) 2 2 0 0
变化量(mol) 1.6 1.6 0.8 1.6
平衡量(mol) 0.4 0.4 0.8 1.6
平衡常数K=
=128,
故答案为:1;128;
(2)向容器A中充入1molX、1molY,向容器B中充入2molX、2molY,若B体积为2a,则达到平衡状态AB相同,B气体体积为1,6L,说明B中,相当于体积减小压强增大,平衡正向进行,W的物质的量B>A,A中W和B中W的物质的量比较n(w)A<n(w)B,
故答案为:<;
(3)若T1温度时,容器A中反应的平衡常数为K(A),容器B中反应的平衡常数为K(B),平衡常数只随温度变化,不随浓度变化,则该温度下平衡常数相同,若升高温度到T2,反应是吸热反应,升温平衡逆向进行,平衡常数减小,
故答案为:=;减小;
(4)若保持反应温度为T1,打开K,形成的水恒压容器,依据气体体积之比等于气体物质的量之比计算,6:V=4:1.6,
V=2.4L,则B容器体积=2,4L-2L=0.4L,故答案为:0.4.
2X(g)+2Y(g)→Z(g)+2W(g)
起始量(mol) 2 2 0 0
变化量(mol) 1.6 1.6 0.8 1.6
平衡量(mol) 0.4 0.4 0.8 1.6
平衡常数K=
| ||||
(
|
故答案为:1;128;
(2)向容器A中充入1molX、1molY,向容器B中充入2molX、2molY,若B体积为2a,则达到平衡状态AB相同,B气体体积为1,6L,说明B中,相当于体积减小压强增大,平衡正向进行,W的物质的量B>A,A中W和B中W的物质的量比较n(w)A<n(w)B,
故答案为:<;
(3)若T1温度时,容器A中反应的平衡常数为K(A),容器B中反应的平衡常数为K(B),平衡常数只随温度变化,不随浓度变化,则该温度下平衡常数相同,若升高温度到T2,反应是吸热反应,升温平衡逆向进行,平衡常数减小,
故答案为:=;减小;
(4)若保持反应温度为T1,打开K,形成的水恒压容器,依据气体体积之比等于气体物质的量之比计算,6:V=4:1.6,
V=2.4L,则B容器体积=2,4L-2L=0.4L,故答案为:0.4.
点评:本题考查了化学平衡计算分析,平衡常数计算,平衡影响因素理解应用,注意恒温恒压,恒温恒容容器的分析方法,掌握基础是关键,题目难度中等.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
固体NH4I放入一个体积为VL的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s)?NH3(g)+HI(g);2HI(g)?H2(g)+I2(g).平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是( )
| A、平衡时氨气为2.5mol | ||
| B、平衡时HI的分解率为20% | ||
| C、若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol | ||
D、其他条件不变把容器的体积缩小到
|
下列说法不正确的是( )
| A、Na2O2能与CO2反应,可用作呼吸面具的供氧剂 |
| B、Al2O3熔点高,可用于制作耐高温仪器 |
| C、明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| D、Cu有良好的导电性,可用于制备光导纤维 |
在密闭烧瓶中充满NO2,在25℃时NO2与N2O4达到平衡:2NO2?N2O4,△H<0 把烧瓶置于100℃沸水中,又建立新的平衡状态,前后两平衡比较,不变的是( )
| A、颜色 | B、平均分子量 |
| C、物质的量 | D、密度 |
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构与双氧水分子相似.常温下,S2Cl2是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
| A、S2Cl2的结构式为Cl-S-S-Cl |
| B、S2Cl2为含有极性键和非极性键的极性分子 |
| C、S2Br2与S2Cl2结构相似,熔沸点S2Cl2>S2Br2 |
| D、2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
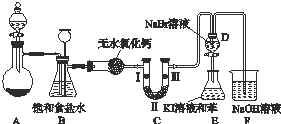 高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如图K103是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如图K103是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).