题目内容
固体NH4I放入一个体积为VL的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s)?NH3(g)+HI(g);2HI(g)?H2(g)+I2(g).平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是( )
| A、平衡时氨气为2.5mol | ||
| B、平衡时HI的分解率为20% | ||
| C、若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol | ||
D、其他条件不变把容器的体积缩小到
|
考点:化学平衡的计算
专题:化学平衡专题
分析:A、根据化学平衡中各物质的量的关系计算;
B、根据转化率是变化量和初始量的比值来计算;
C、体积为VL的真空密闭容器中,多投料碘化铵,则生成的气体量增加,根据压强增加对化学平衡移动的影响来回答;
D、把容器的体积缩小到
L,相当于对体系加压,根据压强增加对化学平衡移动的影响来回答.
B、根据转化率是变化量和初始量的比值来计算;
C、体积为VL的真空密闭容器中,多投料碘化铵,则生成的气体量增加,根据压强增加对化学平衡移动的影响来回答;
D、把容器的体积缩小到
| V |
| 2 |
解答:
解:设容器中氢气的物质的量是x,
NH4I(s)?NH3(g)+HI(g);2HI(g)?H2(g)+I2(g).
1.5+2x 1.5+2x 2x x x
容器中气体共为5mol,即:1.5+2x+1.5+2x=5,解得x=0.5;
A、平衡时氨气为(1.5+2x)mol=2.5mol,故A正确;
B、平衡时HI的分解率为
×100%=
×100%=40%,故B错误;
C、开始时放入固体NH4I的量增大一倍,生成的气体的量增加,恒容容器的压强增大,所以平衡NH4I(s)?NH3(g)+HI(g)会逆向移动,平衡2HI(g)?H2(g)+I2(g)无影响,导致衡时气体小于10 mol,故C错误;
D、其他条件不变把容器的体积缩小到
L,压强增大,所以平衡NH4I(s)?NH3(g)+HI(g)会逆向移动,重新达到平衡时H2的浓度小于原平衡的2倍,故D错误.
故选A.
NH4I(s)?NH3(g)+HI(g);2HI(g)?H2(g)+I2(g).
1.5+2x 1.5+2x 2x x x
容器中气体共为5mol,即:1.5+2x+1.5+2x=5,解得x=0.5;
A、平衡时氨气为(1.5+2x)mol=2.5mol,故A正确;
B、平衡时HI的分解率为
| 2x |
| 1.5+2x |
| 1 |
| 2.5 |
C、开始时放入固体NH4I的量增大一倍,生成的气体的量增加,恒容容器的压强增大,所以平衡NH4I(s)?NH3(g)+HI(g)会逆向移动,平衡2HI(g)?H2(g)+I2(g)无影响,导致衡时气体小于10 mol,故C错误;
D、其他条件不变把容器的体积缩小到
| V |
| 2 |
故选A.
点评:本题涉及化学平衡的计算和影响化学平衡移动的因素知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
下列有关试剂的保存方法,错误的是( )
| A、金属钠保存在煤油中 |
| B、存放FeSO4溶液时加入少量铁粉 |
| C、NaOH溶液保存在带橡胶塞的玻璃试剂瓶中 |
| D、FeCl3溶液保存在广口瓶中 |
N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料,下列有关说法正确的是( )
| A、该物质只具有氧化性 |
| B、该物质的摩尔质量是152 |
| C、15.2g该物质含有6.02×1023个原子 |
| D、该物质既有氧化性又有还原性 |
合成氨反应:3H2+N2?2NH3,其反应速率分别为v(H2)、v(N2)、v(NH3)(用mol?L-1?s-1表示),则正确的关系式是( )
| A、v(H2)=v(N2)=v(NH3) |
| B、v(N2)=2v(NH3) |
| C、2v(H2)=3v(NH3) |
| D、v(N2)=3v(H2) |
下列标明电子转移的方向和数目的化学方程式中正确的是( )
A、 |
B、 |
C、 |
D、 |
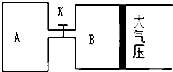 如图所示,当关闭K时,向容器A中充入1molX、1molY,向容器B中充入2molX、2molY,
如图所示,当关闭K时,向容器A中充入1molX、1molY,向容器B中充入2molX、2molY,