题目内容
在密闭烧瓶中充满NO2,在25℃时NO2与N2O4达到平衡:2NO2?N2O4,△H<0 把烧瓶置于100℃沸水中,又建立新的平衡状态,前后两平衡比较,不变的是( )
| A、颜色 | B、平均分子量 |
| C、物质的量 | D、密度 |
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:可逆反应2NO2(g)?N2O4(g)达到平衡状态,升高温度,化学平衡向着逆向移动,二氧化氮物质的量增大、四氧化二氮物质的量减小;该反应中二氧化氮为红棕色气体、四氧化二氮为无色气体;反应两边都是气体,气体的总质量不变,烧瓶的容积不变,结合ρ=
知气体的密度一定不会变化.
| m |
| V |
解答:
解:把烧瓶置于100℃沸水中,升高了温度,该反应向着逆向移动,
A、由于升高温度,平衡向着逆向移动,二氧化氮浓度增大,气体的颜色加深,所以反应前后气体的颜色不相同,故A错误;
B、反应两边都是气体,气体的总质量不变;反应方程式两边气体的体积不相等,平衡向着逆向移动,混合物的物质的量增大,平均分子量减小,所以反应前后气体的平均分子量不相同,故B错误;
C、方程式两边气体的体积不相等,平衡向着逆向移动,混合气体的物质的量增大,所以反应前后气体的物质的量不相等,故C错误;
D、反应两边都是气体,气体的总质量不变,烧瓶的容积固定,根据ρ=
,气体的密度一定不会变化,故D正确;
故选D.
A、由于升高温度,平衡向着逆向移动,二氧化氮浓度增大,气体的颜色加深,所以反应前后气体的颜色不相同,故A错误;
B、反应两边都是气体,气体的总质量不变;反应方程式两边气体的体积不相等,平衡向着逆向移动,混合物的物质的量增大,平均分子量减小,所以反应前后气体的平均分子量不相同,故B错误;
C、方程式两边气体的体积不相等,平衡向着逆向移动,混合气体的物质的量增大,所以反应前后气体的物质的量不相等,故C错误;
D、反应两边都是气体,气体的总质量不变,烧瓶的容积固定,根据ρ=
| m |
| V |
故选D.
点评:本题考查了温度对化学平衡的影响,题目难度中等,可以根据平衡移动原理判断温度对化学平衡的影响,试题侧重对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
相关题目
下列关于材料的说法不正确的是( )
| A、太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 |
| B、二氧化硅可用作光导纤维 |
| C、石英玻璃耐强酸强碱,可用来制造化学仪器 |
| D、Si3N4是一种新型无机非金属材料,可用于制造发动机 |
某元素基态原子的外围电子排布为3d54s2,则下列说法不正确的是( )
| A、该元素为Mn元素 |
| B、该元素原子核外有4个能层 |
| C、该元素原子最外层共有7个电子 |
| D、该元素属于d区元素 |
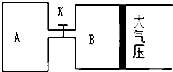 如图所示,当关闭K时,向容器A中充入1molX、1molY,向容器B中充入2molX、2molY,
如图所示,当关闭K时,向容器A中充入1molX、1molY,向容器B中充入2molX、2molY,