题目内容
14. 某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示:
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示:(1)该反应的化学方程式是2X?3Y+Z.
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol 氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,该反应吸收的热量为36.8 kJ;在此t1 min时间内,用H2表示反应的平均速率v(H2)为$\frac{0.6}{{t}_{1}}$ mol/(L•min).
分析 (1)化学反应中,各物质的物质的量的变化值与化学计量数呈正比,以此书写化学方程式;
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol 氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,分解氨气物质的量2.4mol-1.6mol=08mol,据此计算反应放出的热量,反应速率v=$\frac{△c}{△t}$.
解答 解:(1)由图象可以看出,X的物质的量逐渐减小,则X为反应物,Y、Z的物质的量逐渐增多,作为Y、Z为生成物,当反应到达2min时,△n(X)=0.8mol,△n(Y)=1.2mol,△n(Z)=0.4mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,
则△n(X):△n(Y):△n(Z)=2:3:1,所以反应的化学方程式为:2X?3Y+Z;
故答案为:2X?3Y+Z;
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol 氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,分解氨气物质的量2.4mol-1.6mol=08mol,据此计算反应放出的热量=$\frac{46×0.8}{1}$KJ=36.8 kJ,
在此t1 min时间内,氢气生成物质的量为1.2mol,用H2表示反应的平均速率v(H2)=$\frac{\frac{1.2mol}{2L}}{{t}_{1}min}$=$\frac{0.6}{{t}_{1}}$ mol/(L•min),
故答案为:36.8 kJ,$\frac{0.6}{{t}_{1}}$mol/(L•min).
点评 本题考查了根据图象写方程式、计算反应速率、计算转化率,解题关键是学会看图的一些基本方法,题目难度不大.

练习册系列答案
相关题目
4.只用一种试剂就能鉴别CaCl2、NH4Cl、Na2SO4、(NH4)2SO4四种溶液,此试剂是( )
| A. | Ba(OH)2 | B. | NaOH | C. | HCl | D. | Na2CO3 |
5.25℃,加水将10mL pH=11的氨水稀释至1L,则下列判断中正确的是( )
| A. | 稀释后溶液的pH=9 | |
| B. | 稀释过程中,溶液中所有离子的浓度均减小 | |
| C. | 稀释后溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ 减小 | |
| D. | 该氨水稀释前后中和盐酸的能力相同 |
2.下列物质的制备,不符合工业生产实际的是( )
| A. | 工业上用电解熔融氯化镁制镁蒸汽 | |
| B. | 工业上用钠和熔融氯化钾反应制取钾(850℃) | |
| C. | 工业上用碳酸钠制取碳酸氢钠 | |
| D. | 工业上炼铁时,常用石灰石除去铁矿石中的SiO2 |
9.原电池产生电流的本质原因是( )
| A. | 电解质溶液中有电离出的自由移动的离子 | |
| B. | 有导线将两个活泼性不同的电极连接 | |
| C. | 在不同金属的两极间存在电势差 | |
| D. | 在原电池中发生了氧化还原反应 |
19.下列物质中,只含有极性共价键的是( )
| A. | NaOH | B. | H2 | C. | NaCl | D. | H2S |
19.某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:1 下列说法正确的是( )
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:2 | ||
| C. | 分子中一定含有氧原子 | D. | 此有机物的最简式为CH2 |
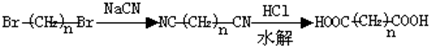 现用乙烯和其它无机物为原料合成环状有机物E(C6H8O4)的流程如下:
现用乙烯和其它无机物为原料合成环状有机物E(C6H8O4)的流程如下: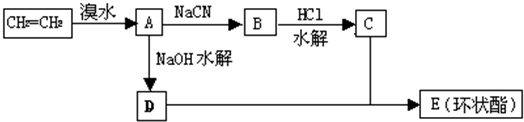
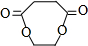 +2H2O.
+2H2O. 具有相同官能团的同分异构体的结构简式为CH2=CH-CH2COOH,CH3-CH=CH-COOH.
具有相同官能团的同分异构体的结构简式为CH2=CH-CH2COOH,CH3-CH=CH-COOH.