题目内容
9.在反应MnO2+4HCl(浓)═MnCl2↑+Cl2↑+2H2O中,当有7.3g HCl被氧化时,生成Cl2的质量为( )| A. | 14.2g | B. | 7.3g | C. | 3.65g | D. | 7.1g |
分析 反应MnO2+4HCl(浓)═MnCl2↑+Cl2↑+2H2O中,HCl中-1价氯原子被氧化成氯气,根据Cl元素质量守恒可计算出生成氯气的物质的量,然后根据m=nM计算出生成氯气的质量.
解答 解:氧化还原反应MnO2+4HCl(浓)═MnCl2↑+Cl2↑+2H2O,HCl被氧化生成氯气,7.gHCl的物质的量为:$\frac{7.3g}{36.5g/mol}$=0.2mol,
根据Cl元素守恒可知生成氯气的物质的量为:n(Cl2)=$\frac{1}{2}$×0.2mol=0.1mol,
所以生成Cl2的质量为71g/mol×0.1mol=7.1g,
故选D.
点评 本题考查了化学方程式的计算,题目难度不大,明确氧化还原反应的特征为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
19.下列电解质溶液的有关叙述正确的是( )
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)═c(CH3COO-) |
20.为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
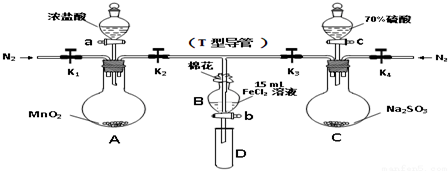
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,加热A.
Ⅲ.当B中溶液变黄时,停止加热,夹紧K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,并检验其中的离子.
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后夹紧K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子..
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰.
(2)若向第Ⅲ步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式2Fe3++H2S═2Fe2++2H++S↓
(3)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4
(4)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是甲(填“甲”“乙”“丙”)
(5)将B中的FeCl2溶液换成100mLFeBr2溶液并向其中通入1.12LCl2(标准状况下),若溶液中有$\frac{1}{2}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为0.5mol/L.

实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,加热A.
Ⅲ.当B中溶液变黄时,停止加热,夹紧K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,并检验其中的离子.
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后夹紧K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子..
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰.
(2)若向第Ⅲ步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式2Fe3++H2S═2Fe2++2H++S↓
(3)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4
(4)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是甲(填“甲”“乙”“丙”)
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
4.下列说法不正确的是( )
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化不一定都是化学反应 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是大于生成物的总能量 |
7.下列有关物质用途的说法中,错误的是( )
| A. | 氯气可用于制漂白粉 | B. | 液氨可用作制冷剂 | ||
| C. | 活性炭可以去除冰箱中的异味 | D. | 二氧化硅可做半导体材料 |
8.科学家将液态的金属镓(Ga)充入碳纳米管中,发明出一种世界上最小的温度计-碳纳米管温度计.该温度计通过电子显微镜进行读数,精确度较高,其测量范围在18℃~490℃.下列说法错误的是( )
| A. | 碳纳米管中的镓为液体 | |
| B. | 金属镓的体积在10℃~500℃之间随温度的变化比较均匀 | |
| C. | 碳纳米管的体积在10℃~500℃之间随温度的变化很小 | |
| D. | Al(OH)3、Ga(OH)3均是两性氧化物 |
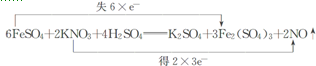 .
.