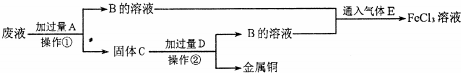
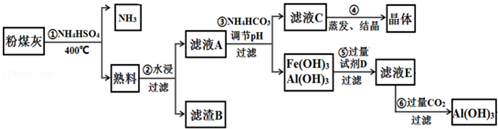
题目内容
1.下列离子方程式书写正确的是( )| A. | 碳酸钙与稀盐酸反应CO32-+2H+═CO2↑+H2O | |
| B. | 稀硫酸与氯化钡溶液反应Ba2++SO42-═BaSO4 | |
| C. | 氢氧化镁与稀硫酸反应OH--+H+═H2O | |
| D. | 铁钉放入硫酸铜溶液中2Fe+3Cu2+═2Fe3++3Cu |
分析 A.碳酸钙与盐酸反应中,碳酸钙为难溶物,需要保留化学式;
B.稀硫酸与氯化钡反应生成硫酸钡沉淀和氯化氢;
C.氢氧化镁为难溶物,离子方程式中需要保留化学式;
D.铁与硫酸铜溶液反应生成硫酸亚铁和铜.
解答 解:A.碳酸钙与盐酸反应生成氯化钙、二氧化碳气体和水,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.稀硫酸与氯化钡溶液反应生成硫酸钡和氯化氢,反应的离子方程式为:Ba2++SO42-═BaSO4,故B正确;
C.氢氧化镁需要保留化学式,正确的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,故C错误;
D.铁钉放入硫酸铜溶液中,扶生成硫酸亚铁和铜,正确的离子方程式为:Fe+Cu2+═Fe2++Cu,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
12.在下列各溶液中离子一定能大量共存的是( )
| A. | 强碱溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 含0.1mol?L-1Fe3+的溶液中:K+、Ba2+、NO3-、SO42- | |
| C. | 含0.1mol?L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 室温下c(H+)=0.1mol?L-1的溶液中:Na+、Fe3+、NO3-、SO42- |
9.短周期元素甲、乙、丙、丁的原子序数依次增大,甲形成的化合物种类最多,乙、丙、丁为同周期元素,其最高价氧化物对应的水化物两两之间能相互反应,丁的原子序数为甲、乙原子序数之和.下列说法正确的是( )
| A. | 元素丙的单质可用于冶炼金属 | |
| B. | 甲的氢化物比丁的氢化物热稳定性强 | |
| C. | 简单离子半径:乙>丁>丙 | |
| D. | 甲与乙的氧化物均有强氧化性 |
16.铬(Cr)有多种化合物,在工业生产中有广泛的用途.
(1)工业上利用铬铁矿(FeO Cr2O3)冶炼铬的工艺流程如下:
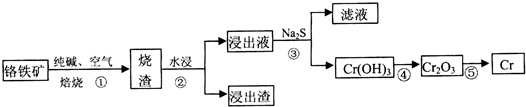 a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).
a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).
b.浸出液中含有的主要成分为Na2CrO4,向滤液中加酸化的氯化钡溶液有白色沉淀生成,则操作③发生反应的离子方程式CrO42-+Ba2+=BaCrO4↓.
(2)铬的化合物有毒,排放前要经过处理,通常用电解法:
将含Cr2O72-的废水放入电解槽内,加入一定量氯化钠,用铁作电极提供Fe2+,Cr2O72-将Fe2+氧化生成Fe3+,本身被还原生成Cr3+,最后Cr3+和Fe3+以Cr(OH)3和Fe(OH)3的形式除去.铁作电解槽的阳极,阴极反应式为2H++2e-=H2↑,Cr2O72-氧化Fe2+的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O.
(3)CrO3是一种常见的铬的氧化物,其热稳定性较差,加热时逐步分解.取100gCrO3加热,剩余固体的质量随温度的变化如下表所示.
则x=84.00,y为Cr2O5(写化学式).
(1)工业上利用铬铁矿(FeO Cr2O3)冶炼铬的工艺流程如下:
 a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).
a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).b.浸出液中含有的主要成分为Na2CrO4,向滤液中加酸化的氯化钡溶液有白色沉淀生成,则操作③发生反应的离子方程式CrO42-+Ba2+=BaCrO4↓.
(2)铬的化合物有毒,排放前要经过处理,通常用电解法:
将含Cr2O72-的废水放入电解槽内,加入一定量氯化钠,用铁作电极提供Fe2+,Cr2O72-将Fe2+氧化生成Fe3+,本身被还原生成Cr3+,最后Cr3+和Fe3+以Cr(OH)3和Fe(OH)3的形式除去.铁作电解槽的阳极,阴极反应式为2H++2e-=H2↑,Cr2O72-氧化Fe2+的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O.
(3)CrO3是一种常见的铬的氧化物,其热稳定性较差,加热时逐步分解.取100gCrO3加热,剩余固体的质量随温度的变化如下表所示.
| 温度/K | 480 | 505 | 615 | 730 |
| 质量/g | 94.67 | 92.00 | x | 76.00 |
| 化学式 | Cr3O8 | y | CrO2 | Cr2O3 |
13.有K2SO4、Al2(SO4)3的混合溶液,已知其中的Al3+、SO42-的浓度分别为0.4mol/L、0.7mol/L,则该溶液中K+的物质的量浓度为( )
| A. | 0.1mol/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.25mol/L |
2.100mL 6mol•L-1 H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | Na2CO3(s) | B. | 水 | C. | 硝酸钾溶液 | D. | 盐酸 |