题目内容
下列说法正确的是( )
| A、相同温度下,0.1mol?L-1NH4Cl溶液中NH4+的浓度比0.1mol?L-1氨水中NH4+的浓度大; |
| B、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| C、电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气; |
| D、对于Al(OH)3(s)?Al(OH)3(aq)?Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡; |
| E、除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大; |
考点:盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质,电解原理
专题:
分析:A、相同温度下,铵盐溶液中铵根微弱水解,0.1mol?L-1NH4Cl溶液中,铵根离子浓度略小于0.1mol/L,氨水是弱电解质存在电离平衡,溶液中NH4+的浓度远远小于0.1mol/L;
B、依据沉淀溶解平衡分析判断;
C、电解饱和食盐水阳极上氯离子失电子生成氯气,阴极上是氢离子得到电子生成氢气,破坏水的电离平衡,氢氧根离子浓度增大;
D、氢氧化铝难溶于水,在水中形成沉淀溶解平衡,氢氧化铝是弱碱电离过程存在电离平衡状态;
E、氢氧化镁溶解度小于碳酸镁;
B、依据沉淀溶解平衡分析判断;
C、电解饱和食盐水阳极上氯离子失电子生成氯气,阴极上是氢离子得到电子生成氢气,破坏水的电离平衡,氢氧根离子浓度增大;
D、氢氧化铝难溶于水,在水中形成沉淀溶解平衡,氢氧化铝是弱碱电离过程存在电离平衡状态;
E、氢氧化镁溶解度小于碳酸镁;
解答:
解:A、相同温度下,铵盐溶液中铵根微弱水解,0.1mol?L-1NH4Cl溶液中,铵根离子浓度略小于0.1mol/L,氨水是弱电解质存在电离平衡,溶液中NH4+的浓度远远小于0.1mol/L,相同温度下,0.1mol?L-1NH4Cl溶液中NH4+的浓度比0.1mol?L-1氨水中NH4+的浓度大,故A正确;
B、依据沉淀溶解平衡分析判断,银离子浓度和氯离子浓度乘积为常数,用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小,故B正确;
C、电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上是氢离子得到电子生成氢气,阴极得到氢氧化钠溶液和氢气,故C错误;
D.对于Al(OH)3(s)?Al(OH)3(aq)?Al3+(aq)+3OH-(aq),氢氧化铝难溶于水,在水中形成沉淀溶解平衡,氢氧化铝是弱碱电离过程存在电离平衡状态,前段为溶解平衡,后段是电离平衡,故D正确;
E.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的小,故E错误.
故答案为:ABD.
B、依据沉淀溶解平衡分析判断,银离子浓度和氯离子浓度乘积为常数,用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小,故B正确;
C、电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上是氢离子得到电子生成氢气,阴极得到氢氧化钠溶液和氢气,故C错误;
D.对于Al(OH)3(s)?Al(OH)3(aq)?Al3+(aq)+3OH-(aq),氢氧化铝难溶于水,在水中形成沉淀溶解平衡,氢氧化铝是弱碱电离过程存在电离平衡状态,前段为溶解平衡,后段是电离平衡,故D正确;
E.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的小,故E错误.
故答案为:ABD.
点评:本题考查了热化学方程式书写方法,盐类水解的分析应用,电解原理和产物的判断,沉淀溶解平衡的分析判断是解题关键,题目难度中等

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
氢化铝锂(LiAlH4)是化工生产中的重要试剂,溶于水能放出氢气.下列叙述中正确的是( )
| A、氢化铝锂溶于水后溶液呈中性 |
| B、氢化铝锂与水反应的过程中,氢化铝锂中的氢被还原成氢气 |
| C、氢化铝锂中各微粒的半径大小关系为Al3+>H->Li+ |
| D、氢化铝锂与水反应的过程中,氢化铝锂表现出强氧化性 |
实验室用下列两种方法制氯气:①用含HCl 4mol的浓盐酸与足量的MnO2反应;②用1mol MnO2与足量浓盐酸反应.所得的氯气( )
| A、①比②多 | B、②比①多 |
| C、一样多 | D、无法比较 |
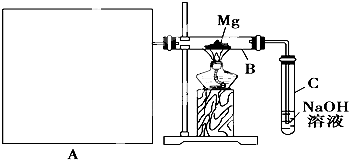 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性.