题目内容
某混合物的水溶液,可能含有以下离子中的若干种K+、NH4+、Al3+、Ba2+、CO32-、SO42-、Cl-、Br-.现分别取100mL的三等份溶液进行如下实验
①第一份加过量浓NaOH溶液加热后,收集到气体0.02mol,无沉淀生成,同时得到溶液甲.再向甲溶液中通人过量的CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02g固体.
②第二份加足量盐酸酸化的BaC12溶液,经过滤、洗涤、干燥后,得到沉淀的质量为11.65g,
③第三份加CCl4,滴加少量氯水,振荡后静置,CCl4层未变红色;
依据实验回答下列问题
(1)分析上述实验,写出每一实验可以确定离子一定存在或不存在的种类.
实验①可以确定一定存在的离子有 ,一定不存在的离子有 ;
实验②可以确定一定存在的离子有 ,一定不存在的离子有 ;
实验③可以确定一定不存在的离子有 .
(2)试通过分析与计算,原溶液中K+的物质的量浓度为 mol?L-1.
①第一份加过量浓NaOH溶液加热后,收集到气体0.02mol,无沉淀生成,同时得到溶液甲.再向甲溶液中通人过量的CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02g固体.
②第二份加足量盐酸酸化的BaC12溶液,经过滤、洗涤、干燥后,得到沉淀的质量为11.65g,
③第三份加CCl4,滴加少量氯水,振荡后静置,CCl4层未变红色;
依据实验回答下列问题
(1)分析上述实验,写出每一实验可以确定离子一定存在或不存在的种类.
实验①可以确定一定存在的离子有
实验②可以确定一定存在的离子有
实验③可以确定一定不存在的离子有
(2)试通过分析与计算,原溶液中K+的物质的量浓度为
考点:常见阴离子的检验,常见阳离子的检验
专题:
分析:第一份加过量NaOH溶液后加热,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲,依据离子性质分析推断,与氢氧化钠生成气体的一定是NH4+离子,生成气体NH3物质的量为0.02mol,无沉淀生成证明溶液中一定不含Fe3+、Mg2+;向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体.能与二氧化碳反应得到沉淀的离子有Ba2+,铝离子溶于过量氢氧化钠生成的偏铝酸钠溶于反应生成氢氧化铝沉淀;
第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体.说明沉淀不溶于酸,证明是硫酸钡沉淀,原溶液中含有SO42-,判断溶液中一定不含有Ba2+,向甲溶液中通入过量CO2,生成白色沉淀只能是氢氧化铝沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体为氧化铝,原溶液中含有Al3+;
第三份加CCl4,滴加少量氯水,振荡后静置,CCl4层未变红色,说明不存在:Br-;
结合离子共存判断溶液中一定不含有CO32-;结合溶液电荷守恒判断溶液中的钾离子存在.
第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体.说明沉淀不溶于酸,证明是硫酸钡沉淀,原溶液中含有SO42-,判断溶液中一定不含有Ba2+,向甲溶液中通入过量CO2,生成白色沉淀只能是氢氧化铝沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体为氧化铝,原溶液中含有Al3+;
第三份加CCl4,滴加少量氯水,振荡后静置,CCl4层未变红色,说明不存在:Br-;
结合离子共存判断溶液中一定不含有CO32-;结合溶液电荷守恒判断溶液中的钾离子存在.
解答:
解:第一份加过量NaOH溶液后加热,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲,依据离子性质分析推断,与氢氧化钠生成气体的一定是NH4+离子,生成气体NH3物质的量为0.02mol,无沉淀生成证明溶液中一定不含Fe3+、Mg2+;向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体.能与二氧化碳反应得到沉淀的离子有Ba2+,铝离子溶于过量氢氧化钠生成的偏铝酸钠溶于反应生成氢氧化铝沉淀;第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体.说明沉淀不溶于酸,证明是硫酸钡沉淀,原溶液中含有SO42-,判断溶液中一定不含有Ba2+,向甲溶液中通入过量CO2,生成白色沉淀只能是氢氧化铝沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体为氧化铝,原溶液中 含有Al3+,第三份加CCl4,滴加少量氯水,振荡后静置,CCl4层未变红色,说明不存在:Br-;结合离子共存判断溶液中一定不含有CO32-;一定含有的离子为NH4+、Al3+、SO42-;
(1)分析上述实验,写出每一实验可以确定离子一定存在或不存在的种类.
实验①可以确定一定存在的离子有:NH4+、Al3+,一定不存在的离子有:CO32-;
实验②可以确定一定存在的离子有:SO42-,一定不存在的离子有:Ba2+;
实验③可以确定一定不存在的离子有:Br-,故答案为:NH4+、Al3+;CO32-;SO42-;Ba2+;Br-;
(2)由①可知存在离子NH4+ 物质的量=0.02mol,1.02g固体为氧化铝,故Al3+的物质的量为:2×
=0.02mol,第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体为硫酸钡,物质的量=
=0.05mol,依据溶液中电荷守恒,阳离子正电荷总量小于阴离子负电荷总量,阳离子电荷数为0.08mol,阴离子若只有硫酸根离子时电荷数为0.1mol,所以一定有K+存在,且钾离子的物质的量≥0.1-0.08=0.02mol,故浓度为:≥
=0.2mol/L,
故答案为:0.2.
(1)分析上述实验,写出每一实验可以确定离子一定存在或不存在的种类.
实验①可以确定一定存在的离子有:NH4+、Al3+,一定不存在的离子有:CO32-;
实验②可以确定一定存在的离子有:SO42-,一定不存在的离子有:Ba2+;
实验③可以确定一定不存在的离子有:Br-,故答案为:NH4+、Al3+;CO32-;SO42-;Ba2+;Br-;
(2)由①可知存在离子NH4+ 物质的量=0.02mol,1.02g固体为氧化铝,故Al3+的物质的量为:2×
| 1.02g |
| 102g/mol |
| 11.65g |
| 233g/mol |
| 0.02mol |
| 0.1L |
故答案为:0.2.
点评:本题考查了常见离子的检验方法,离子性质的应用,反应现象的判断,离子共存的分析应用,明确铝离子、硫酸根离子、铵根离子的分析判断和计算是解答的关键,题目难度中等.

练习册系列答案
相关题目
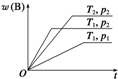 密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、T1<T2,p1<p2,a+b>c,正反应为吸热反应 |
| B、T1>T2,p1<p2,a+b<c,正反应为吸热反应 |
| C、T1<T2,p1>p2,a+b<c,正反应为吸热反应 |
| D、T1>T2,p1>p2,a+b>c,正反应为放热反应 |
与氢气完全加成后,能生成2-甲基丁烷的烃是( )
| A、CH2=CH-CH2-CH3 |
| B、CH2=C(CH3) CH=CH2 |
| C、(CH3)2CHCH=CH2 |
| D、(CH3)3CCH═CH2 |
下列实验能达到目的是( )
| A、在容量瓶中加一定体积的水,再加入浓盐酸配制准确浓度的稀盐酸 |
| B、蒸馏操作时在蒸馏烧瓶中加入沸石以防止爆沸 |
| C、用玻璃棒搅拌漏斗中的液体以加快过滤的速度 |
| D、加入盐酸以除去硫酸钠中的少量碳酸钠杂质 |
除去FeCl2溶液中少量的氯化铁,可行的办法是( )
| A、加铁粉 |
| B、通Cl2 |
| C、加铜粉 |
| D、滴入KSCN溶液 |
下列说法正确的是( )
| A、相同温度下,0.1mol?L-1NH4Cl溶液中NH4+的浓度比0.1mol?L-1氨水中NH4+的浓度大; |
| B、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| C、电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气; |
| D、对于Al(OH)3(s)?Al(OH)3(aq)?Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡; |
| E、除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大; |
 A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如图所示.A为地壳中含量仅次于氧的非金属单质,其晶体结构与金刚石相似.
A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如图所示.A为地壳中含量仅次于氧的非金属单质,其晶体结构与金刚石相似.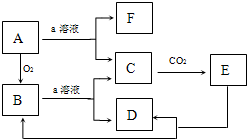 如图物质的转化关系中,A为难熔固体单质,E为一种白色不溶物,a是焰色反应呈黄色的强碱溶液.据此回答:
如图物质的转化关系中,A为难熔固体单质,E为一种白色不溶物,a是焰色反应呈黄色的强碱溶液.据此回答: