题目内容
氢化铝锂(LiAlH4)是化工生产中的重要试剂,溶于水能放出氢气.下列叙述中正确的是( )
| A、氢化铝锂溶于水后溶液呈中性 |
| B、氢化铝锂与水反应的过程中,氢化铝锂中的氢被还原成氢气 |
| C、氢化铝锂中各微粒的半径大小关系为Al3+>H->Li+ |
| D、氢化铝锂与水反应的过程中,氢化铝锂表现出强氧化性 |
考点:镁、铝的重要化合物
专题:元素及其化合物
分析:A、氢化钠和水反应生成氢气和氢氧化钠;
B、氢化铝锂中氢负离子失电子被氧化生成氢气;
C、电子层数相同,原子序数越小,半径越大,电子层数越多,半径越大;
D、反应中,氢化铝锂中氢负离子失电子被氧化生成氢气,氢化铝锂表现出强还原性.
B、氢化铝锂中氢负离子失电子被氧化生成氢气;
C、电子层数相同,原子序数越小,半径越大,电子层数越多,半径越大;
D、反应中,氢化铝锂中氢负离子失电子被氧化生成氢气,氢化铝锂表现出强还原性.
解答:
解:A、氢化铝锂和水发生:LiAlH4+4H2O=4H2+LiOH+Al(OH)3↓,有LiOH生成,其水溶液显碱性,故A错误;
B、氢化铝锂中氢负离子失电子被氧化生成氢气,故B错误;
C、Al3+有两层电子,故Al3+的半径最大,Li+、H-均只有一层电子,且Li+的核电荷数较大,故Li+的半径最小,故C正确;
D、反应中,氢化铝锂中氢负离子失电子被氧化生成氢气,氢化铝锂表现出强还原性,故D错误;
故选:C.
B、氢化铝锂中氢负离子失电子被氧化生成氢气,故B错误;
C、Al3+有两层电子,故Al3+的半径最大,Li+、H-均只有一层电子,且Li+的核电荷数较大,故Li+的半径最小,故C正确;
D、反应中,氢化铝锂中氢负离子失电子被氧化生成氢气,氢化铝锂表现出强还原性,故D错误;
故选:C.
点评:本题考查了粒子半径比较及元素化合物的知识,题目难度不大,注意利用盐类水解理解LiAlH4与水的反应原理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
向恒温恒容密闭容器中加入1molHI,发生下列反应2HI(g)═H2(g)+I2(g),△H>0.达到平衡后,往容器中再加入1molHI,有关说法正确的是( )
| A、平衡不移动,HI平衡转化率不变 |
| B、平衡向右移动,HI平衡转化率不变 |
| C、平衡向左移动,HI平衡转化率减小 |
| D、平衡向右移动,HI平衡转化率增大 |
除去FeCl2溶液中少量的氯化铁,可行的办法是( )
| A、加铁粉 |
| B、通Cl2 |
| C、加铜粉 |
| D、滴入KSCN溶液 |
下列说法正确的是( )
| A、相同温度下,0.1mol?L-1NH4Cl溶液中NH4+的浓度比0.1mol?L-1氨水中NH4+的浓度大; |
| B、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| C、电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气; |
| D、对于Al(OH)3(s)?Al(OH)3(aq)?Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡; |
| E、除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大; |
100mL 3mol?L-1稀盐酸与一定量的锌充分反应,锌全部溶解,生成的氢气在标准状况下体积为1.12L,设反应后溶液的体积仍为100mL,则反应后溶液中H+物质的量浓度为( )
| A、2 mol?L-1 |
| B、1 mol?L-1 |
| C、0.5 mol?L-1 |
| D、0.25 mol?L-1 |
 A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如图所示.A为地壳中含量仅次于氧的非金属单质,其晶体结构与金刚石相似.
A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如图所示.A为地壳中含量仅次于氧的非金属单质,其晶体结构与金刚石相似.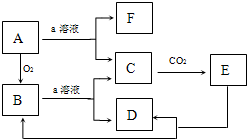 如图物质的转化关系中,A为难熔固体单质,E为一种白色不溶物,a是焰色反应呈黄色的强碱溶液.据此回答:
如图物质的转化关系中,A为难熔固体单质,E为一种白色不溶物,a是焰色反应呈黄色的强碱溶液.据此回答: