题目内容
12.下列各组物质不用其它试剂就可以全部鉴别出来的是( )| A. | 稀盐酸、稀H2SO4 | B. | KCl、BaCl2、CuSO4 | ||
| C. | KCl、BaCl2、CaCl2 | D. | FeCl3、Fe2(SO4)3、NaCl | ||
| E. | FeCl3、Fe2(SO4)3、NaCl |
分析 不要试剂鉴别,可以通过溶液的颜色判断,可根据溶液间相互反应产生的不同现象鉴别,特别注意的是已经鉴别出来的试剂可以用来鉴别其它剩余的物质,据此分析解题.
解答 A.稀盐酸和稀硫酸均为无色溶液,且彼此间不发生反应,无法鉴别,故A错误;
B.硫酸铜溶液显蓝色,可直接确定,再用硫酸铜溶液与其它两种溶液混合滴加,有白色沉淀生成的是BaCl2,剩下的为KCl,故B正确;
C.KCl、BaCl2、CaCl2都是无色溶液,且彼此间不发生反应,无法鉴别,故C错误;
D.FeCl3、Fe2(SO4)3都是棕黄色溶液,NaCl溶液是无色的,可确定,无法鉴别其它两种,故D错误;
E.FeCl3、Fe2(SO4)3都是棕黄色溶液,NaCl溶液是无色的,可确定,无法鉴别其它两种,故E错误;
故选:B.
点评 物质的鉴别是高频考点,重点考查物质的性质及离子反应,属基础性考查,难度不大.

练习册系列答案
相关题目
3.现有E、F、G、M、N五种可溶的强电解质,它们在水中电离产生下列离子(各种离子不重复).
已知:①E、F两溶液呈碱性;G、M、N 溶液呈酸性.
②向N溶液中逐滴滴加F溶液至过量,沉淀量先增加后减少但不消失.
③M溶液与另外四种溶液反应都能产生沉淀.
下列说法正确的是( )
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
②向N溶液中逐滴滴加F溶液至过量,沉淀量先增加后减少但不消失.
③M溶液与另外四种溶液反应都能产生沉淀.
下列说法正确的是( )
| A. | N溶液与过量的F溶液反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| B. | E溶液与N溶液混合发生反应的离子方程式为:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| C. | M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中 | |
| D. | 将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为2H++CO32-═CO2↑+H2O |
20.一定条件下,向一带活塞的密闭容器中充入1mol N2和3mol H2,发生下列反应:N2(g)+3H2(g)═2NH3(g),反应达到平衡后,改变下述条件,NH3 气体平衡浓度不改变的是( )
| A. | 保持温度和容器压强不变,充入1 mol NH3(g) | |
| B. | 保持温度和容器体积不变,充入1 mol NH3(g) | |
| C. | 保持温度和容器压强不变,充入1 mol N2(g) | |
| D. | 保持温度和容器体积不变,充入1 mol Ar(g) |
7.下列各表述与示意图一致的是( )
| A. | 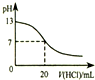 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 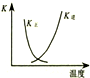 如图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 如图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 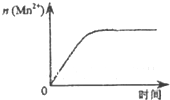 如图表示10 mL 0.0l mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 如图表示10 mL 0.0l mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 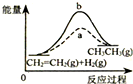 如图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 如图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 |
17.某氯化镁溶液的密度为1.2g.cm-3,其中镁离子的质量分数为4.0%,500mL该溶液中Cl-的物质的量等于(不考虑镁离子的水解)( )
| A. | 0.5 mol | B. | 1.0 mol | C. | 2.0 mol | D. | 4.0 mol |
19.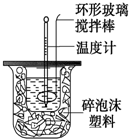 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)倒入NaOH溶液的正确操作是C
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后成溶液的比热容c=4.18J/(g•℃).利用上表数据计算该反应放出的热量为:1.4212kJ.
(4)利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度; c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)倒入NaOH溶液的正确操作是C
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
(4)利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度; c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.