题目内容
A、D、E、X、Y五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子,D元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐;X与A同主族;Y元素的最外层电子数是其次外层电子数的
倍;A、D、X、Y四种元素,每一种均能与E元素形成原子个数比不相同的若干化合物.
(1)画出Y元素离子的结构示意图 ;
写出常温下Y的氢化物与其最高价氧化物对应水化物的浓溶液反应的化学方程式; .
(2)由A、D、E、Y四种元素形成的强酸的酸式盐的化学式为 ,该盐的水溶液中各离子浓度由大到小的顺序为 .
(3)若1克A的单质燃烧放出的热量为M kJ,试写出表示A单质燃烧热的热化学方程式: .
| 3 |
| 4 |
(1)画出Y元素离子的结构示意图
写出常温下Y的氢化物与其最高价氧化物对应水化物的浓溶液反应的化学方程式;
(2)由A、D、E、Y四种元素形成的强酸的酸式盐的化学式为
(3)若1克A的单质燃烧放出的热量为M kJ,试写出表示A单质燃烧热的热化学方程式:
考点:位置结构性质的相互关系应用
专题:
分析:A元素的原子是半径最小的原子,则A为H元素;D元素的最高价氧化物的水化物与其氢化物反应生成一种盐,则D为N元素;X与A同主族,X的原子序数大于N,则X为Na;Y最外层电子数为是其次外层电子数的
倍,次外层是8,故最外层为:
×8=6,原子序数大于Na,即Y为S元素;E能与H、N、Na、S形成元素的原子个数比不相同的若干化合物,结合原子序数可知元素E应为O元素,据此解答各小题即可.
| 3 |
| 4 |
| 3 |
| 4 |
解答:
解:A元素的原子是半径最小的原子,则A为H元素;D元素的最高价氧化物的水化物与其氢化物反应生成一种盐,则D为N元素;X与A同主族,X的原子序数大于N,则X为Na;Y最外层电子数为是其次外层电子数的
倍,次外层是8,故最外层为:
×8=6,原子序数大于Na,即Y为S元素;E能与H、N、Na、S形成元素的原子个数比不相同的若干化合物,结合原子序数可知元素E应为O元素,依据分析可知:A为氢、D为氮、E为氧、X为钠、Y为硫,
(1)Y是S,S元素质子数为16,得到2个电子形成18个电子的稳定结构,带2个负电荷,故S2-的离子结构示意图为 ,常温下硫化氢与硫酸反应生成二氧化硫,该反应硫化氢中S元素化合价由-2价变为0价,硫酸中S元素化合价由+6价变为0价,反应的化学方程式为:3H2S+H2SO4═4S+4H2O;
,常温下硫化氢与硫酸反应生成二氧化硫,该反应硫化氢中S元素化合价由-2价变为0价,硫酸中S元素化合价由+6价变为0价,反应的化学方程式为:3H2S+H2SO4═4S+4H2O;
故答案为: ;3H2S+H2SO4═4S+4H2O;
;3H2S+H2SO4═4S+4H2O;
(2)由H、N、O、S四种元素形成的强酸的酸式盐为硫酸氢铵,硫酸氢铵属于易溶于水的盐,NH4HSO4═NH4++H++SO42-,铵根离子易水解,溶液中的氢离子还有水电离的一小部分,故离子浓度大小顺序为:c(H+)>c(SO42-)>c(NH4+)>c(OH-),
故答案为:NH4HSO4;c(H+)>c(SO42-)>c(NH4+)>c(OH-);
(3)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,依据热化学发生的书写方法写出,标注物质聚集状态,对应量下的焓变,若1克氢气燃烧放出的热量为M kJ,1mol氢气为2g,故氢气的燃烧热的热化学方程式为:H2(g)+
O2(g)=H2O(l)△H=-2MkJ/mol,
故答案为:H2(g)+
O2(g)=H2O(l)△H=-2MkJ/mol.
| 3 |
| 4 |
| 3 |
| 4 |
(1)Y是S,S元素质子数为16,得到2个电子形成18个电子的稳定结构,带2个负电荷,故S2-的离子结构示意图为
 ,常温下硫化氢与硫酸反应生成二氧化硫,该反应硫化氢中S元素化合价由-2价变为0价,硫酸中S元素化合价由+6价变为0价,反应的化学方程式为:3H2S+H2SO4═4S+4H2O;
,常温下硫化氢与硫酸反应生成二氧化硫,该反应硫化氢中S元素化合价由-2价变为0价,硫酸中S元素化合价由+6价变为0价,反应的化学方程式为:3H2S+H2SO4═4S+4H2O; 故答案为:
 ;3H2S+H2SO4═4S+4H2O;
;3H2S+H2SO4═4S+4H2O;(2)由H、N、O、S四种元素形成的强酸的酸式盐为硫酸氢铵,硫酸氢铵属于易溶于水的盐,NH4HSO4═NH4++H++SO42-,铵根离子易水解,溶液中的氢离子还有水电离的一小部分,故离子浓度大小顺序为:c(H+)>c(SO42-)>c(NH4+)>c(OH-),
故答案为:NH4HSO4;c(H+)>c(SO42-)>c(NH4+)>c(OH-);
(3)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,依据热化学发生的书写方法写出,标注物质聚集状态,对应量下的焓变,若1克氢气燃烧放出的热量为M kJ,1mol氢气为2g,故氢气的燃烧热的热化学方程式为:H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
点评:本题主要考查的是元素的推断以及离子结构示意图、盐溶液中离子浓度大小比较、热化学反应方程式书写等,综合性较强,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
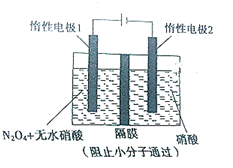 用如图装置电解制备N2O5 ,下列有关说法正确的是( )
用如图装置电解制备N2O5 ,下列有关说法正确的是( )| A、N2O5在惰性电极2处产生 |
| B、在惰性电极2处有氢气产生 |
| C、在惰性电极1处发生还原反应 |
| D、在惰性电极2处有NO产生 |
 NA表示阿伏加德罗常数的值,常温下,抽去图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )
NA表示阿伏加德罗常数的值,常温下,抽去图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )| A、反应前气体的总体积为0.448L |
| B、生成物中含有0.01NA个分子 |
| C、装置中氢元素的总质量为0.04g |
| D、生成物完全溶于水后所得溶液含有0.01 NA个F- |
单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点越高.下列溶液中沸点最高的是( )
| A、0.01 mol/L的蔗糖溶液 |
| B、0.01 mol/L的K2SO4溶液 |
| C、0.02 mol/L的NaCl溶液 |
| D、0.02 mol/L的CH3COOH溶液 |
当光束通过下列分散系时,可观察到丁达尔效应的是( )
| A、NaCl溶液 |
| B、H2SO4溶液 |
| C、CuSO4溶液 |
| D、Fe(OH)3胶体 |
 .
.



