题目内容
A、B、C是单质,其他物质是化合物.并且A是金属,B是空气的主要成分,NA表示阿伏加德罗常数,各种物质间的转化关系如图:
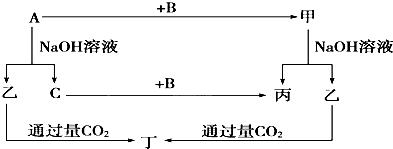
根据图示转化关系回答:(1)写出下列物质的化学式:B ,乙 .
(2)写出下列变化的方程式:①A与NaOH溶液反应的离子方程式 ②乙→丁的化学方程式
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36L,则消耗的A的物质的量为 ,转移电子数目为 .

根据图示转化关系回答:(1)写出下列物质的化学式:B
(2)写出下列变化的方程式:①A与NaOH溶液反应的离子方程式
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36L,则消耗的A的物质的量为
考点:无机物的推断
专题:推断题
分析:A、B、C是单质,其他物质是化合物.并且A是金属,能与氢氧化钠反应生成单质C,故A为铝,B是空气的主要成分,能与铝反应,则B为氧气,根据题中转化关系可知,C为氢气,甲为氧化铝,乙为偏铝酸钠,丙为水,丁为氢氧化铝,据此答题.
解答:
解:A、B、C是单质,其他物质是化合物.并且A是金属,能与氢氧化钠反应生成单质C,故A为铝,B是空气的主要成分,能与铝反应,则B为氧气,根据题中转化关系可知,C为氢气,甲为氧化铝,乙为偏铝酸钠,丙为水,丁为氢氧化铝,
(1)根据上面的分析可知,B为O2,乙为NaAlO2,
故答案为:O2;NaAlO2;
(2)①Al与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,②NaAlO2与CO2反应生成Al(OH)3的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,
故答案为:①2Al+2OH-+2H2O=2AlO2-+3H2↑;②NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(3)将一定量的Al加入到NaOH溶液中,产生的氢气在标准状况下的体积为3.36L,即为0.15mol,则转移电子0.3mol,根据电子得失守恒可知,则消耗的Al的物质的量为
mol=0.1mol,转移电子数目为0.3NA,
故答案为:0.1mol;0.3NA.
(1)根据上面的分析可知,B为O2,乙为NaAlO2,
故答案为:O2;NaAlO2;
(2)①Al与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,②NaAlO2与CO2反应生成Al(OH)3的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,
故答案为:①2Al+2OH-+2H2O=2AlO2-+3H2↑;②NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(3)将一定量的Al加入到NaOH溶液中,产生的氢气在标准状况下的体积为3.36L,即为0.15mol,则转移电子0.3mol,根据电子得失守恒可知,则消耗的Al的物质的量为
| 0.3 |
| 3 |
故答案为:0.1mol;0.3NA.
点评:本题主要考查了铝及其化合物的有关知识,难度不大,解题的关键在根据题中信息确定物质的种类,答题时注意熟记常见元素化合物知识及学会用电子得失守恒进行化学计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
关于如图装置的叙述,正确的是( )


| A、铝是负极,铝片上析出无色气体 |
| B、石墨是阳极,石墨棒上析出黄绿色气体 |
| C、溶液中两电极间产生白色沉淀 |
| D、溶液中先产生白色沉淀,最后沉淀溶解 |
X、Y、Z三种主族元素,已知X+和Y-具有相同电子层结构,Z元素原子核电荷数比Y元素原子核电荷数少9,Y-在一定条件下可被氧化成YZ3-,则下列说法正确的是( )
| A、X、Y、Z均属于短周期元素 |
| B、离子半径X+>Y- |
| C、Y的气态氢化物可形成氢键 |
| D、X、Y、Z三种元素组成的化合物中既含有离子键又含有共价键 |
下列有关化学用语表示正确的是( )
| A、中子数为8的N原子:78N |
B、离子结构示意图: 只能表示35Cl- 只能表示35Cl- |
| C、碳酸氢钠在水溶液中的电离方程式:NaHCO3=Na++HCO3- |
| D、作为相对原子质量标准的碳原子:614C |
某有机物甲经水解可得乙,乙在一定条件下经氧化后可得丙,1mol丙和2mol甲反应得一种含氯的酯(C6H8O4Cl2).由此推断有机物丙的结构简式为( )
A、 |
| B、HOCH2CH2OH |
C、 |
D、 |
临界状态指的是物质的气态和液态平衡共存时的一个边缘状态,在这种状态下,液体密度和饱和的蒸汽密度相同,因而他们的界面小时,这种状态只能在临界温度和临界压强下实现,可用临界点表示.二氧化硫的临界点为 157℃和78 atm,液态二氧化硫在25℃时的蒸汽压强为3.8 atm.试判断下列说法正确是( )
| A、二氧化硫的正常沸点在 25~157℃之间 |
| B、25℃贮有半满液态二氧化硫容器内的压力为5 atm |
| C、气态二氧化硫在150℃,80 atm时不能液化 |
| D、25℃和1 atm下二氧化硫是气体 |
根据下列转化关系,填写下列空白

测知B在标准状况时密度为1.25g/L.
(1)反应①属于 反应;
(2)有机物C的名称为 ;
(3)写出第③④步反应的化学方程式 , ;
(4)比C多一个碳原子的同系物有 种.

测知B在标准状况时密度为1.25g/L.
(1)反应①属于
(2)有机物C的名称为
(3)写出第③④步反应的化学方程式
(4)比C多一个碳原子的同系物有
下列关于原电池的叙述正确的是( )
| A、构成原电池的正极和负极必须是两种不同的金属 |
| B、原电池是将化学能转变为电能的装置 |
| C、原电池中电子流出的一极是负极,该极被还原 |
| D、原电池放电时,电流的方向是从负极到正极 |
 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下: