题目内容
16.Ⅰ.将1.76gHIO3固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示: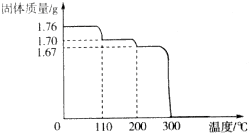
(1)110℃和200℃均为样品的脱水过程,试确定200℃时是否脱水完全:是(填“是”或“否”),判断的理由是2HIO3$\frac{\underline{\;\;△\;\;}}{\;}$I2O5+H2O
2×176 18
1.76g x
x=0.09g
图象可知200°C时固体质量减少1.76g-1.67g=0.09g,说明此时已全部失水(要求写出计算过程).
(2)300℃发生反应的化学方程式为2I2O5$\frac{\underline{\;\;△\;\;}}{\;}$2I2↑+5O2↑.
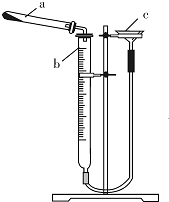
Ⅱ.I2O5为白色固体,易吸水,与CO反应的化学方程式为I2O5+5CO=I2+5CO2,某化学课外话动小组设计实验用I2O5测定空气中CO的含量.可供选择的实验装置如图:

实验步骤如下:
①连接装置,检查气密性,装入药品;
②通入含CO的空气一段时间,观察现象;
③停止通入空气.测定C内沉淀质量.
回答下列问题:
(3)装置正确的连接顺序为cdabghfe(用导管接口字母表示).
(4)B中NaOH溶液的作用为吸收通入空气中的二氧化碳气体.
(5)D中的现象为D中固体部分变为紫黑色.
(6)实验中通入空气的速率为V0mL/min,测得在0-tmin内C装置中生成沉淀质量为mg,假设I2O5足量且与CO充分反应,此条件下的气体摩尔体积为VmL/mol,计算空气中CO的体积分数为$\frac{1000m{V}_{m}}{197{V}_{0}t}$×100%.某同学认为上述方法存在误差,他的理由可能为生成的二氧化碳没有完全被氢氧化钡溶液吸收.
分析 Ⅰ.(1)依据1.76gHIO3全部失水时剩余固体质量,结合图象中固体变化和温度变化分析判断;
(2)200°C-300°C是I2O5分解后无固体剩余,则分解产物为I2和O2;
Ⅱ.(3)I2O5为白色固体,易吸水,与CO反应的化学方程式为I2O5+5CO=I2+5CO2,用I2O5测定空气中CO的含量,需要依据此反应生成产物出现的现象和质量变化,计算一氧化碳的含量,所以空气先通过装置B中氢氧化钠溶液吸收空气中的二氧化碳,防止干扰测定含量,I2O5为白色固体,易吸水,所以再通过装置A中的浓硫酸干燥气体,通入装置D和)I2O5反应,生成的二氧化碳可以利用装置C吸收气体二氧化碳前后的质量变化计算;
(4)装置B中氢氧化钠是除去空气中的二氧化碳;
(5)分析可知,装置D中发生反应I2O5+5CO=I2+5CO2,生成紫黑色固体碘单质;
(6)测得在0-tmin内C装置中生成沉淀质量为mg为BaCO3,是一氧化碳和I2O5反应生成的二氧化碳,物质的量n(BaCO3)=n(CO2)=n(CO)=$\frac{mg}{197g/mol}$=$\frac{m}{197}$mol,空气的体积为V0mL/min×tmin=V0tml=V0t×10-3L,n(空气)=$\frac{{V}_{0}t×1{0}^{-3}L}{{V}_{m}L/mol}$=$\frac{{V}_{0}t×1{0}^{-3}}{{V}_{m}}$mol,计算得到空气中CO的体积分数,某同学认为上述方法存在误差的原因可能是生成的二氧化碳未被氢氧化钡溶液全部吸收;
解答 解:Ⅰ.(1)2HIO3$\frac{\underline{\;\;△\;\;}}{\;}$I2O5+H2O
2×176 18
1.76g x
x=0.09g
图象可知200°C时固体质量减少1.76g-1.67g=0.09g,说明此时已全部失水,
故答案为:是;2HIO3$\frac{\underline{\;\;△\;\;}}{\;}$I2O5+H2O
2×176 18
1.76g x
x=0.09g
图象可知200°C时固体质量减少1.76g-1.67g=0.09g,说明此时已全部失水;
(2)图象分析可知,依据(1)减少可知200°C-300°C是I2O5分解后无固体剩余,则分解产物为I2和O2,反应的化学方程式为:2I2O5$\frac{\underline{\;\;△\;\;}}{\;}$2I2↑+5O2↑,
故答案为:2I2O5$\frac{\underline{\;\;△\;\;}}{\;}$2I2↑+5O2↑;
Ⅱ.(3)I2O5为白色固体,易吸水,与CO反应的化学方程式为I2O5+5CO=I2+5CO2,用I2O5测定空气中CO的含量,需要依据此反应生成产物出现的现象和质量变化,计算一氧化碳的含量,所以空气先通过装置B中氢氧化钠溶液吸收空气中的二氧化碳,防止干扰测定含量,I2O5为白色固体,易吸水,所以再通过装置A中的浓硫酸干燥气体,通入装置D和)I2O5反应,生成的二氧化碳可以利用装置C吸收气体二氧化碳前后的质量变化计算,依据步骤可知装置连接顺序为:cdabghfe,
故答案为:cdabghfe;
(4)装置B中氢氧化钠是除去空气中的二氧化碳,
故答案为:吸收通入空气中的二氧化碳气体;
(5)分析可知,装置D中发生反应I2O5+5CO=I2+5CO2,生成紫黑色固体碘单质,
故答案为:D中固体部分变为紫黑色;
(6)测得在0-tmin内C装置中生成沉淀质量为mg为BaCO3,是一氧化碳和I2O5反应生成的二氧化碳,物质的量n(BaCO3)=n(CO2)=n(CO)=$\frac{mg}{197g/mol}$=$\frac{m}{197}$mol,空气的体积为V0mL/min×tmin=V0tml=V0t×10-3L,n(空气)=$\frac{{V}_{0}t×1{0}^{-3}L}{{V}_{m}L/mol}$=$\frac{{V}_{0}t×1{0}^{-3}}{{V}_{m}}$mol,
空气中CO的体积分数=$\frac{\frac{m}{197}mol}{\frac{{V}_{0}t×1{0}^{-3}}{{V}_{m}}mol}$×100%=$\frac{1000m{V}_{m}}{197{V}_{0}t}$×100%,某同学认为上述方法存在误差的原因可能是生成的二氧化碳未被氢氧化钡溶液全部吸收,
故答案为:$\frac{1000m{V}_{m}}{197{V}_{0}t}$×100%;反应生成的二氧化碳没有完全被氢氧化钡溶液吸收;
点评 本题考查了物质组成的实验探究方法和构成分析判断,主要是物质性质、实验装置连接和装置中试剂作用的分析应用,题目难度中等.

 某学生欲用已知物质的量浓度的盐酸去测定在空气中露置一段时间后的NaOH固体的纯度.设计如下方案:
某学生欲用已知物质的量浓度的盐酸去测定在空气中露置一段时间后的NaOH固体的纯度.设计如下方案:①称取W g样品,准确配成500mL溶液.
②准确配制0.1000mol/L的标准盐酸.
③用滴定管取所配制碱液25.00mL于锥形瓶,并向瓶中滴几滴甲基橙试液.
④向锥形瓶中逐滴滴入标准盐酸,直到终点.
⑤记录数据,计算.请回答:
(1)在①操作中要使用的定量的玻璃仪器是500ml容量瓶.
(2)操作④装标准盐酸的滴定管是酸式滴定管.
(3)滴定过程中左手控制酸式滴定管的活塞,右手向一个方向摇动锥形瓶.眼睛应始终注视锥形瓶内溶液的颜色变化,判断滴定到达终点的现象是滴加最后一滴盐酸,溶液的颜色由黄色变为橙色,且在半分钟内不变色.
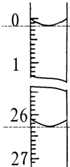
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为26.10ml.
(5)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.15 | ①V=26.20 |
| 第二次 | 25.00 | 0.56 | 30.30 | |
| 第三次 | 25.00 | 0.20 | 26.45 | |
③根据上面结果计算NaOH的纯度$\frac{2.096}{W}$×100%.
(6)下列操作中,可能使测定结果偏低的是ACF.
A.称取样品时,样品和砝码位置放反了
B.配制标准盐酸过程中,读取量筒读数时,俯视刻度线
C.碱式滴定管清洗后,未用待测液润洗
D.酸式滴定管清洗后,未用待测液润洗
E.锥形瓶装液前未干燥,有水珠附着在瓶壁
F.读取酸式滴定管读数时,第一次读数仰视,第二次读数俯视.
| A. | 无色的碱性溶液中:CrO42-、K+、Na+、SO42- | |
| B. | 含有大量ClO-的溶液中:K+、H+、I-、SO42 | |
| C. | -使pH试纸变红的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 水电离产生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
| A. | 结晶氯化钠 | B. | 金刚石 | C. | 碳酸钙 | D. | 二氧化硅 |
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.I.制备
称取14.0g CuSOd•5H20、16.0g Na2CO3.10H20,用研钵分别研细后再混合研磨,立即发生反应,有“滋滋”声,而且混合物很快成为“黏胶状”.将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42-为止,取出沉淀,风干,得到蓝绿色晶体.
(1)①混合物发生反应时有“滋滋”声的原因是有气体生成.
②检验生成物已洗涤干净的方法是取最后一次洗涤液少许于试管中,加入适量盐酸酸化后滴加氯化钡溶液,若无沉淀生成,则没有SO42-,否则含有SO42-
Ⅱ.组成测定
有同学查阅资料发现用Cu(OH)2.CuC03表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2.nCuC03,不同来源的碱式碳酸铜的m、n值需要具体测定.热分解法测定碱式碳酸铜组成的实验装置如图所示.通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值.
(2)①仪器b的名称是碱式滴定管.
②检查装置气密性的方法是连接好装置,通过漏斗向装置中加水,至右侧水面比左侧水面高,静置,水面高度差不发生变化,则装置不 漏气,否则装置漏气.
③三次平行实验测定结果如下表,则该样品中m:n=3:2,若量气管中所盛液体为水,则该测定值比理论值偏大(填“偏大”、“偏小”或“不变”).
| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
(1)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物H2SO4 HCl(填写化学式).
(2)现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2S•Fe2S3)的方法获得铜.火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2 $\frac{\underline{\;800℃\;}}{\;}$Cu2S+3SO2+2FeO,每转移0.6mol电子,有0.1mol硫被氧化.
(3)Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为:2Cu2O+10HNO3=4Cu(NO3)2+NO↑+NO2↑+5H2O.
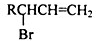
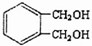 的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式
的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式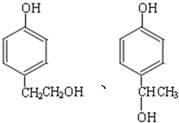 (其中之一);
(其中之一);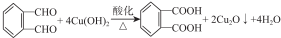 ;
;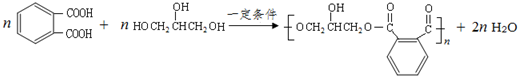 .
.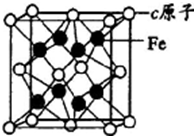 a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:
a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题: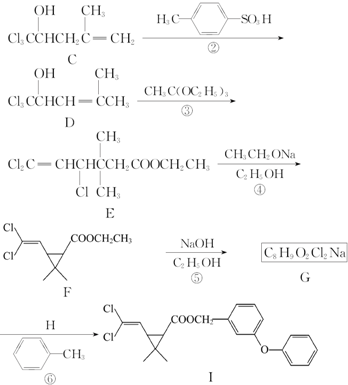
 、
、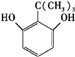 、
、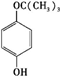 任意一种.
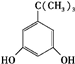
任意一种.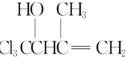 为原料合成
为原料合成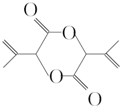 (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件).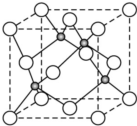 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题: