题目内容
3.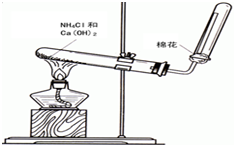 氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.
氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.(1)写出氨气分子的电子式

(2)写出实验室制备氨气的化学反应方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(3)检验氨气收集满的方法是:在集气瓶口放一张湿润的红色石蕊试纸,若变蓝色,表示氨气收集满了.
(4)将生成的氨气溶于水后再滴加酚酞,溶液变红色.
(5)取两根玻璃棒,用第一根玻璃棒醮浓氨水,用第二根玻璃棒醮取浓盐酸,将两根玻璃棒靠近,在两根玻璃棒中间可以看见产生大量的白烟,化学反应方程式为HCl+NH3=NH4Cl.
分析 (1)氨气为共价化合物,N原子的最外层有5个电子,其中3个未成对电子和1对成对电子;
(2)实验室制备氨气是利用氢氧化钙和氯化铵固体混合加热生成;
(3)检验氨气利用氨气是碱性气体,能使湿润的红色石蕊试纸变蓝色验证存在或验满;
(4)氨气溶于水后生成一水合氨是弱碱,再滴加酚酞溶液变红色;
(5)浓氨水和浓盐酸都具有挥发性氨气和氯化氢相遇发生反应生成白色固体氯化铵.
解答 解:(1)N原子的最外层有5个电子,其中3个未成对电子和1对成对电子,3个未成对电子分别和3个H原子形成3对共用电子对,故氨气的电子式为 ,
,
故答案为: ;
;
(2)实验室用氯化铵和碱石灰反应制取氨气,即碱与盐反应生成新碱和新盐,化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)检验氨气是否集满,可以利用氨气的水溶液显碱性,即在集气瓶口放一张湿润的红色石蕊试纸,“使湿润的红色石蕊试纸变蓝”,表示氨气收集满,
故答案为:红色石蕊;
(4)氨气溶于水后生成一水合氨是弱碱,NH3•H2O?NH4++OH-,再滴加酚酞溶液变红色,
故答案为:红;
(5)取两根玻璃棒,用第一根玻璃棒醮浓氨水,用第二根玻璃棒醮取浓盐酸,将两根玻璃棒靠近,在两根玻璃棒中间可以看见产生大量的白烟,浓氨水和浓盐酸都具有挥发性氨气和氯化氢相遇发生反应生成白色固体氯化铵,化学反应方程式为,HCl+NH3=NH4Cl,
故答案为:HCl+NH3=NH4Cl.
点评 本题是教材中最为基本的实验,考查的是氨气的制备、收集、性质验证等,掌握基础知识是解题关键,题目难度不大.

 的是( )
的是( )| A. | CH3CH═CH2和CH4 | B. |  | ||
| C. | CH3CH═CH2和CH4═CH2 | D. |  |
①液氯 ②
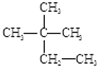 ③O2④18O ⑤
③O2④18O ⑤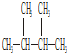
⑥O3⑦16O ⑧氯气 ⑨
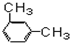 ⑩
⑩
| A. | 1.2mol | B. | 1.6mol | C. | 0.4mol | D. | 0.2mol |
| A. | H2O2的电子式: | |
| B. | 铝离子的结构示意图: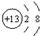 | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同素异形体 |
 汽车尾气产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
汽车尾气产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | 曲线b对应的条件改变可能是加入了催化剂 | |
| B. | 温度T下,随着反应的进行,混合气体的密度减小 | |
| C. | 温度T下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应是吸热反应 |

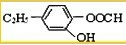
 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: 、C.
、C. 、D.
、D. .
. .
. 、
、 .
.