题目内容
15.实验室用密度为1.25g•mL-1,质量分数为36.5%的浓盐酸配制240mL 0.1mol•L-1的盐酸,请回答下列问题:(1)浓盐酸的物质的量浓度为12.5mol/L.
(2)配制240mL 0.1mol•L-1的盐酸应量取浓盐酸体积2.0mL,应选用容量瓶的规格250mL.
(3)配制时,其正确的操作顺序是BCAFED(用字母表示,每个字母只能用一次).
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡、摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(4)填“偏大”、“偏小”或“无影响”
①用量筒量取浓盐酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中偏大.
②用量筒量取浓盐酸时,仰视读数偏大.
③定容摇匀后,发现液面下降,继续加水至刻度线偏小.
④定容时仰视刻度线偏小.
(5)若实验过程中出现如下情况如何处理?
①加蒸馏水时不慎超过了刻度线重新配制.
②向容量瓶中转移溶液时不慎有溶液溅出重新配制.
分析 (1)依据C=$\frac{1000ρω%}{M}$计算浓盐酸的物质的量浓度;
(2)依据溶液稀释前后所含溶质的物质的量不变计算需要浓盐酸的体积;容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液;
(3)依据用浓溶液配置稀溶液的一般操作步骤解答;
(4)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(5)配制过程中的操作失误,能补救就补救,不能补救就需重新配制.
解答 解:(1)浓盐酸的物质的量浓度C=$\frac{1000×1.25g/mL×36.5%}{36.5g/mol}$=12.5mol/L;
故答案为:12.5mol/L;
(2)要配置240ml的溶液,应选择250ml的容量瓶,设需要浓盐酸的体积为V,依据溶液稀释前后所含溶质的物质的量不变得V×12.5mol/L=250mL×0.1mol•L-1,解得V=2.0ml;容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,根据“大而近”的原则,故应选择250mL容量瓶;
故答案为:2.0;250;
(3)浓溶液配置稀溶液的一般操作步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,故配制步骤为BCAFED;
故答案为:BCAFED;
(4)①用量筒量取浓盐酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中,会导致溶质偏多,则浓度偏高,故答案为:偏大;
②用量筒量取浓盐酸时,仰视读数,会导致所取的浓盐酸的体积偏大,则配制出的溶液的浓度偏高,故答案为:偏大;
③定容摇匀后,发现液面下降是正常的,继续加水至刻度线,则浓度偏小,故答案为:偏小;
④定容时仰视刻度线,则溶液体积偏大,故浓度偏低,故答案为:偏小;
(5)①加蒸馏水时不慎超过了刻度线,无法补救,故应重新配制,故答案为:重新配制;
②向容量瓶中转移溶液时不慎有溶液溅出,由于不知溅出的溶质的量,故无法补救,应重新配制,故答案为:重新配制.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 等质量的H2O与CH2D2含有的质子数相同 | |
| B. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液中H+数目大于0.1NA | |
| C. | 常温下1 L 0.5mol•L-1NH4Cl溶液与2L 0.25mol•L-1NH4Cl溶液所含NH4+的数目相同 | |
| D. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA |
 液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )| A. | 放电时,b极附近溶液pH减小 | |
| B. | a极的反应式为N2H4+4OH--4e-═N2↑+4H2O | |
| C. | 放电时,电子从b极经过负载流向a极 | |
| D. | OH-通过阴离子交换膜向a极移动 |
| A. | Y与W可以组成YW32-、Y2W42- | |
| B. | 由X、Y、Z、W四种元素组成的既能与酸又能与碱反应的化合物,一定属于α-氨基酸 | |
| C. | 若化合物Y2X4W2能发生银镜反应,则该化合物一定是甲酸甲酯 | |
| D. | 混合物Y7X8、Y3 X8W3中X的质量分数约为8.7% |
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)⑧在元素周期表中的位置是第二周期VIA族(周期、族);
(2)8个元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式);
(3)元素⑤、⑦、⑧分别形成的简单气态氢化物中,⑦的电子式为
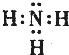 ,稳定性最强的氢化物的结构式为H-O-H;
,稳定性最强的氢化物的结构式为H-O-H;(4)写出①、④的最高价氧化物对应的水化物之间发生反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O;
(5)用电子式表示元素①与⑥形成化合物的过程
 .
.  氮化镓是目前最热门的半导体材料,应用前景非常广阔.已有科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4,装置如图所示,回答下列问题:
氮化镓是目前最热门的半导体材料,应用前景非常广阔.已有科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4,装置如图所示,回答下列问题: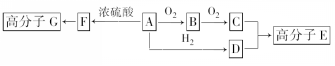
 .
. +2H2O.
+2H2O.