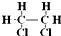题目内容
5.已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4$?_{放电}^{充电}$2H2O+2PbSO4;镍镉碱性充电电池在放电时,其正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用.镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用.回答下列问题:
(1)铅蓄电池在放电时的负极反应为Pb-2e-+SO42-=PbSO4Pb+SO42--2e-=PbSO4,其在充电时阳极反应为PbSO4-2e-+2H2O=PbO2+4H++SO42-PbSO4+2H2O-2e-=PbO2+SO42-+4H+;
(2)镍镉碱性充电电池在充电时的总反应的化学方程式为Cd(OH)2+2Ni(OH)2=Cd+2NiO(OH)+2H2OCd(OH)2+2Ni(OH)2=Cd+2NiO(OH)+2H2O;
(3)上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是铅蓄电池中电解质H2SO4会不断被消耗,故电阻增大,而镍镉电池中碱不会被消耗,电阻不会增大铅蓄电池放电时离子浓度减小,而镍镉电池放电时离子浓度不变;
(4)如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO42mol.
分析 (1)依据铅蓄电池的总反应方程式中元素化合价变化判断,负极失电子发生氧化反应;正极得到电子发生还原反应,负极Pb-2e-+SO42-=PbSO4;正极PbO2+4H++SO42-+2e-=PbSO4+2H2O,充电的阳极是正极的逆反应;
(2)依据放电时的电极反应,充电时是电解,原电池的正极接电源正极做阳极,原电池负极接电源负极,做电解池的阴极,综合写出电解反应;
(3)依据两种电池的电极反应过程中离子浓度变化分析判断;
(4)依据电极反应或电池反应中电子守恒计算得到.
解答 解:(1)铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4 $?_{充电}^{放电}$2H2O+2PbSO4;铅失电子生成硫酸铅,二氧化铅得到电子发生还原反应生成硫酸铅;负极电极反应为:Pb+SO42--2e-=PbSO4,正极电极反应为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,充电的阳极是正极的逆反应为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,
故答案为:Pb+SO42--2e-=PbSO4; PbSO4-2e-+2H2O=PbO2+4H++SO42-;
(2)镍镉碱性充电电池在放电时,
正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-,充电为阳极电极反应为:2Ni(OH)2+2OH--2e-=2NiO(OH)+2H2O,
负极反应为:Cd+2OH--2e-=Cd(OH)2,充电为阴极电极反应为:Cd(OH)2+2e-=Cd+2OH-,
电子守恒合并得到:Cd(OH)2+2Ni(OH)2=Cd+2NiO(OH)+2H2O;
故答案为:Cd(OH)2+2Ni(OH)2=Cd+2NiO(OH)+2H2O;
(3)两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变,阳极电极反应分析说明,铅蓄电池放电时离子浓度减小,而镍镉电池放电时离子浓度不变,
故答案:铅蓄电池中电解质H2SO4会不断被消耗,故电阻增大,而镍镉电池中碱不会被消耗,电阻不会增大;
(4)如果铅蓄电池在放电时回路中有2mol电子转移时,依据Pb+PbO2+2H2SO4 $?_{充电}^{放电}$2H2O+2PbSO4,关系式为Pb~PbO2~2H2SO4~2e-,电子转移为2mol,消耗硫酸为2mol,
故答案为:2mol.
点评 本题考查了原电池的原理应用和电解原理应用,电极反应、电极判断、电池反应是解题关键,题目难度中等.

| A. | 分子个数 | B. | 物质的量 | C. | 物质的质量 | D. | 原子个数 |
| A. | 煤的气化与液化 | B. | 液体燃料呈雾状喷出 | ||
| C. | 通入大量的空气 | D. | 将煤块粉碎 |
| A. | 元素周期表有7个周期、18个族 | |
| B. | 天然气是一种清洁的化石燃料 | |
| C. | 工业上常用电解NaCl水溶液的方法制取金属钠 | |
| D. | 淀粉和纤维素互为同分异构体 |
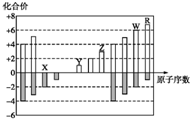
| A. | 离子原子半径:X2->Y+>Z3+ | |
| B. | 气态氢化物的沸点:X>R | |
| C. | 最高价氧化物的水化物的酸性:W>R | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
 .
.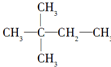 ,则A的结构简式为(CH3)3CCH=CH2.
,则A的结构简式为(CH3)3CCH=CH2.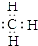 ;②Cl-的结构示意图:
;②Cl-的结构示意图: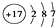 ;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型:
;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型: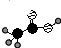 ;⑥氯乙烷的结构式:
;⑥氯乙烷的结构式: