题目内容
16.设NA为阿伏加德罗常数的值,下列说法不正确的是( )| A. | 等质量的H2O与CH2D2含有的质子数相同 | |
| B. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液中H+数目大于0.1NA | |
| C. | 常温下1 L 0.5mol•L-1NH4Cl溶液与2L 0.25mol•L-1NH4Cl溶液所含NH4+的数目相同 | |
| D. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA |
分析 A、H2O与CH2D2的摩尔质量均为18g/mol,两者均含10个质子;
B、醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进其电离;
C、盐溶液中,溶液越稀,盐类的水解程度越大;
D、用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则说明电解时阳极上析出的是0.1mol氧气,阴极上析出的是0.1mol铜和0.1mol氢气.
解答 解:A、H2O与CH2D2的摩尔质量均为18g/mol,故质量相等时两者的物质的量相等,而两者均含10个质子,故含有的质子数也相等,故A正确;
B、室温下向1 L pH=1的醋酸溶液中氢离子的个数为0.1NA个,而醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进其电离,故加水稀释,所得溶液中H+数目大于0.1NA,故B正确;
C、尽管NH4Cl的总量相同,但NH4+水解程度不同,由于浓度越小,水解程度越大,故前者NH4+数目大,C错误;
D、用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则说明电解时阳极上析出的是0.1mol氧气,阴极上析出的是0.1mol铜和0.1mol氢气,故共转移0.4NA电子,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.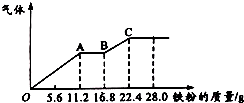 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 混合酸中H2SO4浓度为4 mol•L-1 | |
| B. | 200mL混合酸中NO3-物质的量为0.2mol | |
| C. | AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| D. | 加入铜粉的那份混合酸,反应后剩余0.1mol H2SO4 |
11.糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质,下列说法不正确的是( )
| A. | 油脂水解可生成高级脂肪酸和丙三醇 | |
| B. | 淀粉水解的最终产物能与新制的Cu(OH)2悬浊液反应 | |
| C. | 淀粉和纤维素的分子式均可用(C6H10O5)n表示,他们互为同分异构体 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 |
1.下列除去杂质(括号内为杂质)的方法正确的是( )
①乙烷(乙烯)催化剂、加热条件下通入氢气
②乙酸乙酯(乙酸)用饱和碳酸钠溶液洗涤、分液
③苯(乙酸)用氢氧化钠溶液洗涤、分液
④乙醇(乙酸)加足量生石灰、蒸馏
⑤苯(苯酚)加入浓溴水、过滤.
①乙烷(乙烯)催化剂、加热条件下通入氢气
②乙酸乙酯(乙酸)用饱和碳酸钠溶液洗涤、分液
③苯(乙酸)用氢氧化钠溶液洗涤、分液
④乙醇(乙酸)加足量生石灰、蒸馏
⑤苯(苯酚)加入浓溴水、过滤.
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②④⑤ |
8.下列有关化学键的叙述,正确的是( )
| A. | 离子化合物中一定只含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 仅含有共价键的化合物一定是共价化合物 | |
| D. | 由不同种非金属元素的原子形成的共价化合物一定只含极性键 |
5.常温下,下列各组离子一定能大量共存的是( )
| A. | c(H+)=10-4 mol•L-1的溶液中:NH4+、K+,SO42-,NO3- | |
| B. | 无色溶液中:Na+,Cu2+,Cl-,NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液中:H+,K+,SO42-,I- | |
| D. | 饱和氯水中:Cl-,Na+,NO3-,SO32- |

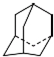 ,用一个氯原子与一个溴原子取代后形成的二元取代物数目为( )
,用一个氯原子与一个溴原子取代后形成的二元取代物数目为( )