题目内容
16.将m g钠和铝的合金,投入水中,充分反应后得到1L偏铝酸钠溶液(合金完全反应),同时产生标准状况下4.48L气体,则合金中钠的质量分数为46%,c(NaAlO2)=0.1mol•L-1.分析 钠和铝的合金,投入水中,首先发生2Na+2H2O=2NaOH+H2↑,然后发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,反应后得到偏铝酸钠溶液,可知n(Na)=n(Al),结合方程式以及生成氢气的体积可计算Na、Al的物质的量,进而计算体积分数和浓度.
解答 解:钠和铝的合金,投入水中,首先发生2Na+2H2O=2NaOH+H2↑,然后发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知n(H2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
反应后得到偏铝酸钠溶液,可知n(Na)=n(Al),设Na、Al的物质的量分别为xmol,由方程式可知分别生成0.5xmol、1.5xmol氢气,
则0.5xmol+1.5xmol=0.2mol,
x=0.1,
则m(Na)=0.1mol×23g/mol=2.3g,
m(Al)=0.1mol×27g/mol=2.7g,
ω(Na)=$\frac{2.3}{2.3+2.7}×100%$=46%,
n(NaAlO2)=n(Al)=0.1mol,
c(NaAlO2)=$\frac{0.1mol}{1L}$=0.1mol/L.
故答案为:46%;0.1.
点评 本题考查了混合物反应的计算,为高频考点,明确发生反应的实质为解答关键,试题培养了学生的分析能力及化学计算能力,题目难度中等.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
5.下列各项正确的是( )
| A. | 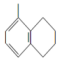 所有碳原子可能在同一平面上 所有碳原子可能在同一平面上 | |
| B. | 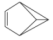 的一氯代物有4种 的一氯代物有4种 | |
| C. | 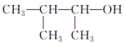 的命名为2,3-二甲基-l-丙醇 的命名为2,3-二甲基-l-丙醇 | |
| D. | 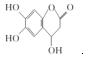 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 |
6.对化工生产认识正确的是( )
| A. | 海水提溴:一般需要经过浓缩、氧化、提取三个步骤 | |
| B. | 合成氯化氢:通入H2的量略大于C12,可以使平衡正移 | |
| C. | 合成氨:采用500℃的高温,有利于增大反应正向进行的程度 | |
| D. | 侯德榜制碱法:析出NaHCO3的母液中加入消石灰,可以循环利用NH3 |
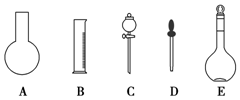 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: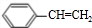 ;.
;.
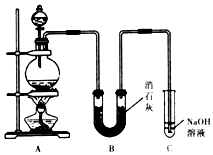 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取漂白粉,据此回答下列问题:
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取漂白粉,据此回答下列问题: MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O CaCl2+Ca(ClO)2+2H2O
CaCl2+Ca(ClO)2+2H2O