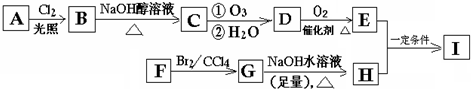
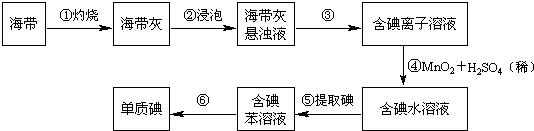
题目内容
X、Y、Z、W、R分别属于不同主族的短周期元素,原子序数依次增大,X的气态氢化物分子只有一对孤对电子;Y、Z、W的最高价氧化物的水化物可以两两相互反应.
(1)写出X在周期表中的位置 ;Z3+的核外电子排布式 .
(2)Y、Z、R的第一电离能大小顺序为 (用元素符号表示),W、R元素最高价含氧酸中酸性较强的是
(用化学式表示).
(3)W最高正价氧化物分子构型为 ;将该氧化物溶于水,则所得溶液阴离子中W的杂化轨道类型为
.
(4)将R的单质与Y的最高价氧化物对应水化物混合,其反应的离子方程式为 .
(5)已知4Y(s)+O2(g)═2Y2O(s),△H=-akJ?mol-1,W的燃烧热为bkJ?mol-1,则4Y(s)+WO2(g)═W(s)+2Y2O(s),△H= kJ?mol-1.
(1)写出X在周期表中的位置
(2)Y、Z、R的第一电离能大小顺序为
(3)W最高正价氧化物分子构型为
(4)将R的单质与Y的最高价氧化物对应水化物混合,其反应的离子方程式为
(5)已知4Y(s)+O2(g)═2Y2O(s),△H=-akJ?mol-1,W的燃烧热为bkJ?mol-1,则4Y(s)+WO2(g)═W(s)+2Y2O(s),△H=
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W、R五种分属于不同主族的短周期元素,原子序数依次增大,X的气态氢化物分子只有一对孤对电子,X应处于ⅤA族,结合原子序数可知X不可能为P,只能为N元素;Y、Z、W的最高价氧化物的水化物可以两两相互反应,应是氢氧化铝与强碱、强酸的反应,结合原子序数可推知Y为Na、Z为Al、W为S、R为Cl,据此解答.
解答:
解:X、Y、Z、W、R五种分属于不同主族的短周期元素,原子序数依次增大,X的气态氢化物分子只有一对孤对电子,X应处于ⅤA族,结合原子序数可知X不可能为P,只能为N元素;Y、Z、W的最高价氧化物的水化物可以两两相互反应,应是氢氧化铝与强碱、强酸的反应,结合原子序数可推知Y为Na、Z为Al、W为S、R为Cl,
(1)X为N元素,在周期表中的位置是:第二周期第VA族,Al3+的核外电子排布式为:1s22s22p6,故答案为:第二周期第VA族;1s22s22p6;
(2)同周期随原子序数增大第一电离能呈增大趋势,故第一电离能Na<Al<Cl,W为S、R为Cl,它们的最高价氧化物对应的水化物分别为H2SO4、HClO4,由于Cl的非金属性强于S,故最高价氧化物对应水合物(即最高价含氧酸)的酸性:HClO4>H2SO4,故答案为:Na<Al<Cl;HClO4>H2SO4;
(3)W最高正价氧化物为SO3,分子中S原子价层电子对数=3+
=3,S原子没有孤对电子,故分子构型为平面三角形;将该氧化物溶于水得到硫酸溶液,则所得溶液阴离子为SO42-,离子中S原子价层电子对数=4+
=4,故S原子采取sp3杂化,
故答案为:平面三角形;sp3;
(4)氯气与NaOH溶液反应生成氯化钠、次氯酸钠与水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(5)Y为钠,即4Na(s)+O2(g)═2Na2O(s),△H=-akJ?mol-1①;W为S,S的燃烧热为bkJ?mol-1,即:S(s)+O2(g)=SO2(g)△H=-bkJ?mol-1②;
4Na(s)+SO2(g)═S(s)+2Na2O(s),此反应是由①-②得到的,故△H=-a-(-b)=(-a+b)kJ?mol-1,故答案为:-a+b.
(1)X为N元素,在周期表中的位置是:第二周期第VA族,Al3+的核外电子排布式为:1s22s22p6,故答案为:第二周期第VA族;1s22s22p6;
(2)同周期随原子序数增大第一电离能呈增大趋势,故第一电离能Na<Al<Cl,W为S、R为Cl,它们的最高价氧化物对应的水化物分别为H2SO4、HClO4,由于Cl的非金属性强于S,故最高价氧化物对应水合物(即最高价含氧酸)的酸性:HClO4>H2SO4,故答案为:Na<Al<Cl;HClO4>H2SO4;
(3)W最高正价氧化物为SO3,分子中S原子价层电子对数=3+
| 6-2×3 |
| 2 |
| 6+2-2×4 |
| 2 |
故答案为:平面三角形;sp3;
(4)氯气与NaOH溶液反应生成氯化钠、次氯酸钠与水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(5)Y为钠,即4Na(s)+O2(g)═2Na2O(s),△H=-akJ?mol-1①;W为S,S的燃烧热为bkJ?mol-1,即:S(s)+O2(g)=SO2(g)△H=-bkJ?mol-1②;
4Na(s)+SO2(g)═S(s)+2Na2O(s),此反应是由①-②得到的,故△H=-a-(-b)=(-a+b)kJ?mol-1,故答案为:-a+b.
点评:本题主要考查结构性质位置关系应用,涉及核外电子排布、电离能、杂化轨道、分子空间结构、盖斯定律的应用等,难度不大,推断元素是解题的关键,注意基础知识的掌握.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
下列说法正确的是( )
| A、H2的摩尔质量是2g |
| B、标准状态下,1molH2O 的体积是22.4L |
| C、氧气的摩尔质量是32g/mol |
| D、2gH2含6.02×1023 个H |
据科学家预测,月球的土壤中吸附着数百万吨的
He,每百吨
He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以
He的形式存在.下列说法正确的是( )
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
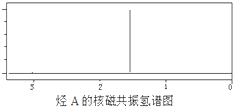 某烃A经李比希元素分析实验测得碳的质量分数为85.71%,该烃的质谱图显示:分子离子峰的最大质荷比为84,该烃的核磁共振氢谱如图所示.红外光谱表明分子中没有碳碳双键,已知烯烃经臭氧作用发生反应:
某烃A经李比希元素分析实验测得碳的质量分数为85.71%,该烃的质谱图显示:分子离子峰的最大质荷比为84,该烃的核磁共振氢谱如图所示.红外光谱表明分子中没有碳碳双键,已知烯烃经臭氧作用发生反应: