题目内容
下列实验不能达到目的是( )
| 序号 | 实验目的 | 实验操作 |
| A | 测定某溶液的pH | 用玻璃棒蘸取该溶液点在pH试纸中间 |
| B | 加快锌与稀硫酸制取H2的速率 | 在稀硫酸中滴加少量CuSO4溶液 |
| C | 证明醋酸是弱电解质 | 将CH3COONa晶体加入水中,会促进水的电离平衡 |
| D | 制取无色AlCl3 | 加热蒸发AlCl3溶液 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.依据PH试纸的正确使用方法解答;
B.影响锌与稀硫酸反应的速率的因素有浓度、温度、固体表面积以及原电池反应等,一般来说,增大浓度、升高温度、增大固体表面积或形成原电池反应,都可增大反应速率;
C.能够水解的盐溶液促进了水的电离,水解程度越大,水的电离程度越大;
D.氯化铝水解生成氢氧化铝和氯化氢,加热促进氯化氢挥发,从而促进氯化铝水解,将溶液蒸干得到氢氧化铝固体;
B.影响锌与稀硫酸反应的速率的因素有浓度、温度、固体表面积以及原电池反应等,一般来说,增大浓度、升高温度、增大固体表面积或形成原电池反应,都可增大反应速率;
C.能够水解的盐溶液促进了水的电离,水解程度越大,水的电离程度越大;
D.氯化铝水解生成氢氧化铝和氯化氢,加热促进氯化氢挥发,从而促进氯化铝水解,将溶液蒸干得到氢氧化铝固体;
解答:
解:A.用pH试纸测量溶液pH值的正确做法是:用干燥洁净玻璃棒蘸取溶液点在pH试纸上,跟标准比色卡比较确定该溶液pH,故A正确;
B.加入少量硫酸铜,锌置换出铜形成原电池反应,可增大反应速率,故B正确;
C.CH3COONa为强碱弱酸盐,醋酸根离子的水解,促进了水的电离,故C正确;
D.氯化铝水解AlCl3+3H2O?Al(OH)3+3HCl,生成氢氧化铝和氯化氢,加热促进氯化氢挥发,从而促进氯化铝水解,将溶液蒸干得到氢氧化铝固体,故D错误;
故选D.
B.加入少量硫酸铜,锌置换出铜形成原电池反应,可增大反应速率,故B正确;
C.CH3COONa为强碱弱酸盐,醋酸根离子的水解,促进了水的电离,故C正确;
D.氯化铝水解AlCl3+3H2O?Al(OH)3+3HCl,生成氢氧化铝和氯化氢,加热促进氯化氢挥发,从而促进氯化铝水解,将溶液蒸干得到氢氧化铝固体,故D错误;
故选D.
点评:本题考查了实验方案的设计,较为综合,为高频考点,掌握pH值的正确做法、影响锌与稀硫酸反应的速率的因素、水的电离影响因素是解答关键,题目难度中等.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式的是( )
| A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| C、向明矾溶液中加入过量氢氧化钡溶液:Al3++2SO2-4+2Ba2++4OH-=2BaSO4↓+AlO-2+2H2O |
| D、等物质的量的NaHCO3和Ca(OH)2溶液混合:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
下列叙述不正确的是( )
| A、在实验室里硅酸钠溶液存放在带橡胶塞的试剂瓶中 |
| B、提倡人们购物时不用塑料袋,是为了防止白色污染 |
| C、氟利昂(CCl2F2)因破坏大气臭氧层而导致“温室效应” |
| D、为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
下列表示20Ca的基态原子的核外电子排布不正确的是( )
A、 |
B、 |
| C、1s22s22p63s23p64s2 |
| D、1s22s22p63s23p63d2 |
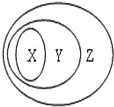 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )