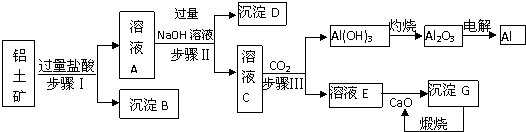
题目内容
1.鉴别NO2和溴蒸汽的方法正确的是 ( )| A. | 用氢氧化钠溶液 | B. | 用湿润的淀粉碘化钾试纸 | ||
| C. | 用硝酸银溶液 | D. | 看颜色 |
分析 二氧化氮和水反应生成硝酸和NO,而溴可溶于水,溴水呈橙黄色,可与硝酸银溶液反应生成浅黄色沉淀;二者都具有强氧化性,二者均与碱反应生成无色溶液,以此解答.
解答 解:A.均与NaOH溶液反应得到无色溶液,现象相同,不能鉴别,故A不选;
B.NO2和Br2蒸气均能氧化KI中的碘离子生成碘单质,遇淀粉变蓝,现象相同,不能鉴别,故B不选;
C.二氧化氮通入到硝酸银溶液,有气体生成,而溴蒸气通入到硝酸银溶液中生成AgBr浅黄色沉淀,现象不同,能鉴别,故C选;
D.均为红棕色,不能鉴别,故D不选;
故选C.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、性质差异为解答的关键,侧重分析与实验能力的考查,注意判断发生的氧化还原反应,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
(1)W位于元素周期表第四周期第Ⅷ族.
(2)X的电负性比Y的小(填“大”或“小”);
(3)X 和Y的气态氢化物中,熔沸点较高的是H2O(写化学式).原因:H2O分子间形成氢键
(4)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目: .
.
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X的电负性比Y的小(填“大”或“小”);
(3)X 和Y的气态氢化物中,熔沸点较高的是H2O(写化学式).原因:H2O分子间形成氢键
(4)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:
 .
.
13.在常温常压下,将10mL某气态烃充分燃烧,消耗65mL的氧气,对该烃的下列说法中正确的是( )
| A. | 该烃能使溴水褪色 | B. | 该烃有三种不同的物质 | ||
| C. | 该烃的一氯取代物4种 | D. | 该烃的二氯取代物6种 |
12.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 60g乙酸与足量乙醇发生酯化反应.充分反应后断裂的C-O键数目为NA | |
| B. | 室温下向1LpH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| D. | 己知C2H4(g)+H2(g)=C2H4(g)△H=-137.0kJ/mol,乙烯与H2加成时放出68.5kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |