题目内容
2.将一份CaCO3粉末放入200mL盐酸中,恰好完全反应,收集到的CO2体积为2.24L(标准状况),求:(1)CaCO3的质量
(2)盐酸的物质的量浓度.
分析 发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,根据n=$\frac{V}{{V}_{m}}$计算CO2的物质的量,根据方程式计算CaCO3的质量,根据c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:CaCO3+2 HCl=CaCl2+CO2↑+H2O
1 2 1
0.1mol 0.2mol $\frac{2.24L}{22.4L/mol}$
(1)碳酸钙的质量为0.1mol×100g/mol=10g,答:石灰石样品中CaCO3的质量分数为10g,
(2)盐酸的物质的量浓度为:$\frac{0.2}{0.2}$=1mol/L,答:盐酸的物质的量浓度为1mol/L.
点评 本题考查化学方程式计算,明确反应中定量关系即可解答,侧重对基础知识的巩固.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案
相关题目
12.下列依据热化学方程式得出的结论正确的是( )
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol | |
| B. | 若P4(白磷,s)=4P(红磷,s)△H=-29.2kJ/mol,则红磷比白磷稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
13.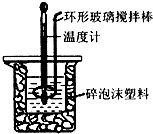 用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪器除胶头滴管外还要50ml量筒;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指混合溶液的最高温度;
(4)计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
(5)若用50mL 0.55mol•L-1的氨水(NH3•H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会偏大(填“偏大”、“偏大”或“不变”),其原因是一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少,△H偏大.
 用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指混合溶液的最高温度;
(4)计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
(5)若用50mL 0.55mol•L-1的氨水(NH3•H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会偏大(填“偏大”、“偏大”或“不变”),其原因是一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少,△H偏大.
10.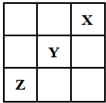 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )| A. | Y的氢化物稳定性大于Z的氢化物稳定性 | |
| B. | Z一定是活泼的金属元素 | |
| C. | Y的最高价氧化物的水化物是一种强酸 | |
| D. | 1molX的单质可以跟足量水反应,转移的电子为2mol |
7.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大2~3 min
(2)哪一段时段的反应速率最小4~5 min.
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L.min).
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)AB.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)哪一段时段的反应速率最小4~5 min.
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L.min).
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)AB.
14.a、b、c、d是四种短周期元素,a、b、d同周期;c、d同主族;a的原子结构示意图为 ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )
 ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )| A. | 原子序数:a>b>c | B. | 单质的活泼性:a>c>d | ||
| C. | 原子半径:c>a>d | D. | 最高价含氧酸的酸性:d>c>a |
11.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见表:
用10mL H2O2制取150mLO2所需的时间(秒)
(1)该小组在设计方案时.考虑了浓度、催化剂、温度等因素对过氧化氢分解速率的影响.
(2)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
一般加入催化剂,反应速率加快(或升高温度反应速率加快,降低温度反应速率减慢;增加反应物浓度,反应速率加快,减小反应物浓度,反应速率减慢).
用10mL H2O2制取150mLO2所需的时间(秒)
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 260 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
(2)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
一般加入催化剂,反应速率加快(或升高温度反应速率加快,降低温度反应速率减慢;增加反应物浓度,反应速率加快,减小反应物浓度,反应速率减慢).