题目内容
下列热化学方程式中,△H能正确表示物质的燃烧热或中和热的是( )
| A、C8H18(l)+12.5O2 (g)=8CO2 (g)+9H2O(l)△H=-5518 kJ?mol-1 |
| B、KOH(aq)+CH3COOH (aq)=CH3COOK(aq)+H2O(l)△H=-57.3 kJ?mol-1 |
| C、2H2(g)+O2(g)=2H2O(l)△H=-572kJ?mol-1 |
| D、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-533kJ?mol-1 |
考点:热化学方程式
专题:化学反应中的能量变化
分析:根据燃烧热表示1mol可燃物完全燃烧生成稳定氧化物所放出的热量;中和热表示强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量.
解答:
解:A、热化学方程式中可燃物是1mol,生成的是二氧化碳和液态水,符合燃烧热的概念,故A正确;
B、CH3COOH是弱酸,电离时要吸热,反应的中和热不是57.3kJ/mol,故B错误;
C、反应热化学方程式中生成的水是气体,不是稳定氧化物,且可燃物不是1mol,故不是燃烧热,故C错误;
D、反应热化学方程式中生成的水是气体,不是稳定氧化物,故D错误;
故选A.
B、CH3COOH是弱酸,电离时要吸热,反应的中和热不是57.3kJ/mol,故B错误;
C、反应热化学方程式中生成的水是气体,不是稳定氧化物,且可燃物不是1mol,故不是燃烧热,故C错误;
D、反应热化学方程式中生成的水是气体,不是稳定氧化物,故D错误;
故选A.
点评:本题考查了中和热、燃烧热的概念应用,注意概念的内涵理解是解题关键,难度不大.

练习册系列答案
相关题目
下列关于化学用语的表示正确的是( )
A、N原子的最外层电子轨道表示式: | ||
B、质子数为35、中子数为45的溴原子:
| ||
C、硫离子的结构示意图: | ||
D、间二甲苯的结构简式: |
在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
| A、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1 452 kJ?mol-1 |
| B、CH3OH(l)+1.5O2(g)=CO2(g)+2H2O(g)△H=-725.8 kJ?mol-1 |
| C、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-725.8 kJ?mol-1 |
| D、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=+1 452 kJ?mol-1 |
下列有关元素周期律的叙述,正确的是( )
| A、随着原子序数的递增,原子最外层电子总是从1到8重复出现 |
| B、元素的性质随着元素原子序数的递增而呈周期性变化 |
| C、随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 |
| D、元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化以及元素主要化合价的周期性变化 |
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是:①NO和O2,②N2和NO2,③NH3和NO,现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
| A、V1>V2>V3 |
| B、V1>V3>V2 |
| C、V2>V3>V1 |
| D、V3>V1>V2 |
已知:H2(g)+Cl2(s)?2HCl(g)△H=+akJ/mol H2(g)+Cl2(g)?2HCl(g)△H=-dkJ/mol 且a、b、c、d均大于零,则下列说法正确的是( )
且a、b、c、d均大于零,则下列说法正确的是( )
 且a、b、c、d均大于零,则下列说法正确的是( )
且a、b、c、d均大于零,则下列说法正确的是( )| A、断开1molH-Cl键所需的能量为-a-b-c |
| B、b>c,则氢气分子具有的能量高于氯气分子具有的能量 |
| C、Cl2(s)=Cl2(g)△H=+(a+d)kJ?mol-1 |
| D、向1molCl2(g)中通入1molH2(g),发生反应时放热dkJ |
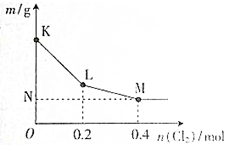 向100mlNaBr和NaI的混合溶液中慢慢通入Cl2(假设Cl2全部反应),使其充分反应后,将所得溶液蒸干、灼烧、得到的固体的质量为m,m与通入的n(Cl2)的关系如图所示,下列说法正确的是( )
向100mlNaBr和NaI的混合溶液中慢慢通入Cl2(假设Cl2全部反应),使其充分反应后,将所得溶液蒸干、灼烧、得到的固体的质量为m,m与通入的n(Cl2)的关系如图所示,下列说法正确的是( )| A、K→L段发生反应的离子方程式为2Br-+Cl2═2Cl-+Br2 |
| B、原溶液中,c(Na+ )=4mol?L-1 |
| C、原溶液中,c(I-)=2mol?L-1 |
| D、M点代表的固体质量为46.8g |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH-
2CO32-+6H2O则下列说法正确的是( )
| 充电 |
| 放电 |
| A、构成该电池的正极和负极必须是两种活性不同的金属 |
| B、充电时有CH3OH生成的电极为阳极 |
| C、放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D、充电时每生成1 mol CH3OH转移12mol电子 |
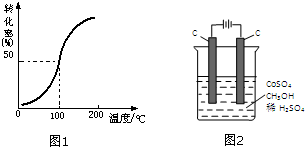 甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.
甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.