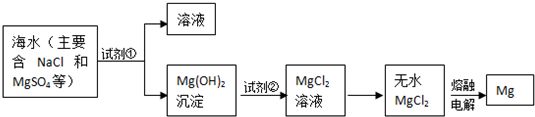
题目内容
5.硫代硫酸钠(Na2S2O3)与稀H2SO4溶液时发生如下反应:Na2S2O3+H2SO4=Na2 SO4+SO2+S↓+H2O 下列反应速率最大的是( )| A. | 0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水5mL,反应温度10℃ | |
| B. | 0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度10℃ | |
| C. | 0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度30℃ | |
| D. | 0.2mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度30℃ |
分析 温度越高、浓度越大,反应速率越快,以此来解答.
解答 解:C、D中温度大于A、B中温度,且C、D相比较,D中浓度大,则D中反应速率最大,
故选D.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意先比较温度后比较浓度,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
15.能证明AlCl3为共价化合物的方法是( )
| A. | AlCl3溶液容易导电 | B. | AlCl3水溶液呈酸性 | ||
| C. | 熔融AlCl3不能导电 | D. | AlCl3溶于水可以电离出Al3+和Cl- |
13. 如图是某有机物分子的球棍式模型,其中大球代表碳原子,小球代表氢原子,短棍代表共价键,该有机物的名称是( )
如图是某有机物分子的球棍式模型,其中大球代表碳原子,小球代表氢原子,短棍代表共价键,该有机物的名称是( )
 如图是某有机物分子的球棍式模型,其中大球代表碳原子,小球代表氢原子,短棍代表共价键,该有机物的名称是( )
如图是某有机物分子的球棍式模型,其中大球代表碳原子,小球代表氢原子,短棍代表共价键,该有机物的名称是( )| A. | 乙烯 | B. | 乙烷 | C. | 乙醇 | D. | 乙炔 |
10.分子式为C7H8O并能与金属钠反应放出氢气的芳香族有机化合物有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
14.为除去H2S气体中混有的少量杂质HCl和CO2气体,应选用的试剂是( )
| A. | 饱和Na2S溶液 | B. | 饱和NaHCO3溶液 | C. | 饱和NaHS溶液 | D. | 饱和NaCl溶液 |
15.除去NaCl溶液中混有的少量Na2SO4,以下加入的试剂和顺序合理的是( )
| A. | BaCl2→Na2CO3→HCl | |
| B. | 过量的BaCl2→过量的Na2CO3→足量的HCl | |
| C. | 过量的Ba(NO3)2→过量的Na2CO3→HCl | |
| D. | Ba(OH)2→Na2CO3→HCl |
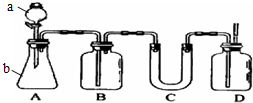 如图A是实验室用石灰石和稀盐酸制取CO2的常用装置.请选用适当的化学试剂和实验用品,用图中的D装置收集一瓶干燥、纯净的CO2气体.
如图A是实验室用石灰石和稀盐酸制取CO2的常用装置.请选用适当的化学试剂和实验用品,用图中的D装置收集一瓶干燥、纯净的CO2气体.