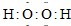题目内容
A、B、C为第二周期、第三周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构.下列说法中正确的是( )
| A、原子序数:A>B>C | B、原子半径:A>B>C | C、离子半径:A2->C->B2+ | D、原子核外最外层电子数:A>C>B |
分析:A、B、C为第二周期、第三周期元素,结合离子所带电荷可知,A是第ⅥA族,B是第ⅡA族,C位于第ⅦA,B2+与C-具有相同的电子层结构,则B位于C的下一周期,由于A、B同周期,则A、B处于第三周期,C处于第二周期,则A为S、B为Mg、C为F,据此解答.
解答:解:A、B、C为第二周期、第三周期元素,结合离子所带电荷可知,A是第ⅥA族,B是第ⅡA族,C位于第ⅦA,B2+与C-具有相同的电子层结构,则B位于C的下一周期,由于A、B同周期,则A、B处于第三周期,C处于第二周期,则A为S、B为Mg、C为F,
A.A为S、B为Mg、C为F,原子序数S>Mg>F,故A正确;
B.同周期自左向右,原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径是Mg>S>F,故B错误;
C.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->F->Mg2+,故C正确;
D.A为S、B为Mg、C为F,原子序数S>Mg>F,原子核外最外层电子数F>S>Mg,故D错误,
故选:AC.
A.A为S、B为Mg、C为F,原子序数S>Mg>F,故A正确;
B.同周期自左向右,原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径是Mg>S>F,故B错误;
C.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->F->Mg2+,故C正确;
D.A为S、B为Mg、C为F,原子序数S>Mg>F,原子核外最外层电子数F>S>Mg,故D错误,
故选:AC.
点评:本题以周期表中元素的推断为载体,考查学生对元素周期表的熟悉程度及对表中各元素性质和相应原子结构的周期性递变规律,是高考中的常见题型,中等难度,注意掌握物质结构与性质关系以及运用元素周期律解决具体化学问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
A、B、C为第二、第三周期的元素,A、B在同周期,A、C最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构.下列说法中,正确的是( )
| A、原子核外最外层电子数:A>C>B | B、离子半径:A2->C->B2+ | C、B和C形成化合物的电子式为B2+[:C:]2 | D、沸点:HC>H2A |