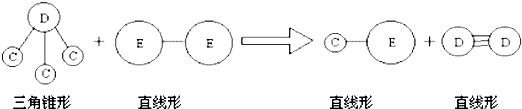
题目内容
A、B、C为第二或第三周期的元素,A、B在同周期,A、C阴离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中,正确的是( )A.原子核外最外层电子数:A>C>B
B.离子半径:A2->C->B2+
C.B和C形成化合物的电子式为![]()
D.沸点:HC>H2A
BD
【解析】 由题意知元素A和元素B在元素C的下一周期,元素A和元素C同主族,B原子最外层2个电子,A最外层6个电子,C最外层7个电子,则答案A错误;离子半径B2+小于C-,A2-比B和C离子多一层电子,是三者中半径最大的,B正确;A为S,C为F,B为Mg,B和C形成化合物的电子式中两个阴离子应该分别写在阳离于的两边,C错误;D中由于HF分子间有氢键存在,故沸点高于H2S,D正确。

练习册系列答案
相关题目
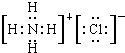
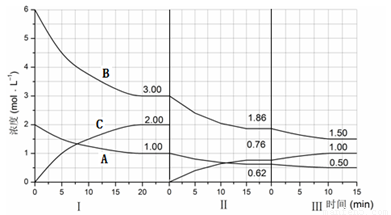
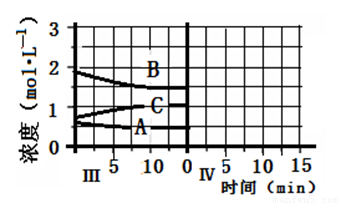
 cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示: