题目内容
以下关于下图说法正确的是
| A.如图表明催化剂可以改变反应的热效应 |
| B.如图表示某反应能量的变化与生成物状态无关 |
| C.如图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| D.如图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒 |
D
解析试题分析:A.催化剂不能改变反应的热效应,只能改变反应的活化能,错误。B.反应能量的变化与生成物状态及量都有关系,错误。C.右图表示的是放热反应,错误。D.右图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒,正确。
考点:本题考查通过能量变化图来分析解决问题的能力。

 53随堂测系列答案
53随堂测系列答案已知下列热化学方程式:
2Zn(s)+O2(g) = 2ZnO(s) ΔH=-702.2 kJ·mol-1
Hg(l)+1/2O2(g) = HgO(s) ΔH=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s) = ZnO(s)+Hg(l)的反应热ΔH为( )
| A.-260.4 kJ·mol-1 | B.+260.4 kJ·mol-1 |
| C.-611.5 kJ·mol-1 | D.+520.8 kJ·mol-1 |
碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g) + I2(?) 2HI(g)+9.48kJ
2HI(g)+9.48kJ
②H2(g) + I2(?) 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
| A.①中的I2为固态,②中的I2为气态 |
| B.②的反应物总能量比①的反应物总能量低 |
| C.①的产物比反应②的产物热稳定性更好 |
| D.1mol 固态碘升华时将吸热17kJ |
镁粉与碘粉均匀混合,滴加几滴水,发生剧烈反应,并产生大量紫色蒸气。以下叙述错误的是
| A.H2O作催化剂 | B.紫色蒸气是I2 |
| C.该反应是放热反应 | D.反应后物质的总能量升高 |
工业上采用NH3作还原剂脱氮原理为:
NO(g)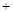 NO2(g)
NO2(g)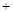 2NH3(g)
2NH3(g)  2N2(g)
2N2(g)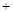 3H2O(g),
3H2O(g),
烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析正确的是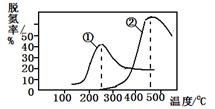
| A.上述反应的正反应为吸热反应 |
| B.催化剂①、②分别适合于250℃和450 ℃左右脱氮 |
| C.曲线①、②最高点表示此时平衡转化率最高 |
| D.相同条件下,改变压强对脱氮率没有影响 |
生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如下图转化。下列说法不正确的是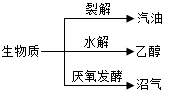
| A.汽油属于纯净物 |
| B.乙醇属于可再生能源 |
| C.沼气的主要成分是甲烷 |
| D.生物质能来源于太阳能 |
下列依据热化学方程式得出的结论正确的是
| A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| B.已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g);ΔH2,则ΔH2>ΔH1 |
| C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol |
已知CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-Q1 ①
2H2(g)+O2(g)=2H2O(g) ΔH=-Q2 ②
H2O(g)=H2O(l) ΔH=-Q3 ③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
| A.4Q1+0.5Q2 | B.4Q1+Q2+10Q3 | C.4Q1+0.5Q2+9Q3 | D.4Q1+2Q2 |
 2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea-Eb)kJ·mol-1。其归纳正确的是 ( )
2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea-Eb)kJ·mol-1。其归纳正确的是 ( )