题目内容
已知下列热化学方程式:
2Zn(s)+O2(g) = 2ZnO(s) ΔH=-702.2 kJ·mol-1
Hg(l)+1/2O2(g) = HgO(s) ΔH=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s) = ZnO(s)+Hg(l)的反应热ΔH为( )
| A.-260.4 kJ·mol-1 | B.+260.4 kJ·mol-1 |
| C.-611.5 kJ·mol-1 | D.+520.8 kJ·mol-1 |
A
解析试题分析:根据盖斯定律可知,目标方程式可由已知的方程式①×1/2-②得来,所以ΔH=(-702.2×1/2+90.7) kJ·mol-1 =-260.4 kJ·mol-1 ,所以选A。
考点:本题考查的是盖斯定律在热化学方程式焓变计算中的应用。

练习册系列答案
相关题目
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.拆开物质中的化学键一定需要吸收能量 |
| C.应用盖斯定律,无法计算某些难以直接测量的反应焓变 |
| D.化学反应都伴随着能量变化和其他各种现象的出现 |
键能是指断开1mol共价键吸收的能量或形成1mol共价键放出的能量,已知H-H键能为436kJ/mol,H-Cl键能为431kJ/mol,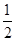 H2(g)+
H2(g)+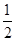 Cl2(g)=HCl(g) △H=-akJ/mol则Cl-Cl键能为
Cl2(g)=HCl(g) △H=-akJ/mol则Cl-Cl键能为
| A.(2a-426)kJ/mol | B.(426-a)kJ/mol |
| C.(426-2a)kJ/mol | D.(426+a)kJ/mol |
下列说法中,正确的是
| A.CO燃烧是放热反应 |
| B.升高温度,可以改变化学反应的反应热 |
| C.1 mol CH3COOH与1 mol NaOH完全中和,所放出的热量为中和热 |
| D.1 mol H2在足量Cl2中完全燃烧所放出的热量,是H2的燃烧热 |
下列反应中生成物的总能量大于反应物总能量的非氧化还原反应是
| A.铝热反应 | B.氯化铝溶液的水解 |
| C.氢氧化钠和盐酸反应 | D.焦炭在高温下与水蒸气反应 |
已知在1×105Pa,298K条件下,1mol氢气燃烧生成水蒸气放出242kJ热量,下列热化学方程式正确的是
| A.H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1 |
| B.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1 |
| C.2H2(g)+O2(g)=2H2O(l)ΔH=-484kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(g)ΔH=+484kJ·mol-1 |
以下关于下图说法正确的是
| A.如图表明催化剂可以改变反应的热效应 |
| B.如图表示某反应能量的变化与生成物状态无关 |
| C.如图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| D.如图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒 |
下列与化学反应能量变化相关的叙述正确的是 ( )。
| A.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| B.1 mol S完全燃烧放热297.3 kJ,其热化学方程式:S+O2=SO2 ΔH=-297.3 kJ·mol-1 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成1 mol BaSO4沉淀时放出的热量叫做中和热 |
| D.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |