题目内容
(1)在9.5g某二价金属的氯化物中含0.2mol Cl-,此氯化物的摩尔质量为 ;该金属元素的相对原子质量为 .
(2)常温下,在27.5g水中溶解12.5g CuSO4?5H2O,恰好达到饱和,该溶液密度为1.21g/cm3,求:
①该溶液中阴阳离子的总物质的量
②该溶液中CuSO4的物质的量浓度
③取出20.0ml该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
(2)常温下,在27.5g水中溶解12.5g CuSO4?5H2O,恰好达到饱和,该溶液密度为1.21g/cm3,求:
①该溶液中阴阳离子的总物质的量
②该溶液中CuSO4的物质的量浓度
③取出20.0ml该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
考点:物质的量浓度的相关计算,物质的量的相关计算
专题:
分析:(1)先根据二价金属A的氯化物的分子式,由Cl-的物质的量求出氯化物的物质的量,再根据公式M=
来确定分子的摩尔质量,摩尔质量在数值上和相对分子质量的大小相等,最后根据相对分子质量的大小确定金属元素的相对原子质量;
(2)①根据n=
计算硫酸铜晶体的物质的量,分别计算Cu2+和SO42-离子的物质的量,二者之和为阴阳离子的总物质的量;
②计算溶液的质量,根据V=
计算溶液体积,再根据c=
计算溶液中CuSO4的物质的量浓度;
③根据稀释定律,溶液稀释前后溶质的物质的量不变,据此计算体积.
| m |
| n |
(2)①根据n=
| m |
| M |
②计算溶液的质量,根据V=
| m |
| ρ |
| n |
| V |
③根据稀释定律,溶液稀释前后溶质的物质的量不变,据此计算体积.
解答:
解:(1)因某二价金属的氯化物ACl2中含有0.4molCl-可知,氯化物ACl2的物质的量为
=0.2mol,则M(ACl2)=
=
=95g/mol,所以ACl2相对分子质量为95,则A的相对原子质量为95-35.5×2=24,
故答案为:95g/mol;24;
(2)①12.5g CuSO4?5H2O的物质的量为:
=0.05mol,电离产生的Cu2+和SO42-均为0.050mol,故阴阳离子的总物质的量为0.050mol+0.050mol=0.1mol,
答:阴阳离子的总物质的量为0.1mol;
②溶液的体积为:
=0.0331L,故CuSO4的物质的量浓度为:
=1.51mol/L,
答:CuSO4的物质的量浓度为1.51mol/L;
③取出溶液中含溶质硫酸铜的物质的量为:1.51mol/L×0.02L=0.0302mol,故稀释后溶液的体积为:
=0.0302L=30.2mL,
答:稀释后溶液的体积是30.2mL.
| 0.4mol |
| 2 |
| m |
| n |
| 19g |
| 0.2mol |
故答案为:95g/mol;24;
(2)①12.5g CuSO4?5H2O的物质的量为:
| 12.5g |
| 250g/mol |
答:阴阳离子的总物质的量为0.1mol;
②溶液的体积为:
| 12.5g+27.5g |
| 1210g/L |
| 0.05mol |
| 0.0331L |
答:CuSO4的物质的量浓度为1.51mol/L;
③取出溶液中含溶质硫酸铜的物质的量为:1.51mol/L×0.02L=0.0302mol,故稀释后溶液的体积为:
| 0.0302mol |
| 1.00mol/L |
答:稀释后溶液的体积是30.2mL.
点评:本题题考查物质的量浓度的有关计算,要求学生掌握化学式和化学式中离子的物质的量的关系,知道摩尔质量在数值上和相对分子质量的大小相等以及质量、摩尔质量、物质的量之间的关系,注意对物质的量浓度的理解与灵活运用,题目难度中等.

练习册系列答案
相关题目
常温下,下列溶液中的微粒浓度关系正确的是( )
| A、新制氯水中加入固体NaOH:[Na+]=[Cl-]+[ClO-]+[OH-] |
| B、pH=8.3的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] |
| C、pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] |
| D、0.2mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合:2[H+]-2[OH-]=[CH3COO-]-[CH3COOH] |
下列关于铝的叙述中,不正确的是( )
| A、铝有抗腐蚀性能是因为其表面能形成致密的氧化膜 |
| B、在高温下铝能将氧化铁中的铁置换出来 |
| C、氢氧化铝既能与强酸反应又能与强碱溶液反应 |
| D、常温下能用铝制容器盛放浓硝酸和浓硫酸,是因为铝在常温下不能与它们发生反应 |
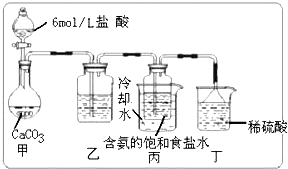
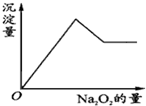 有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种.现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀.加入Na2O2的量与生成白色沉淀的量之间的关系如图:
有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种.现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀.加入Na2O2的量与生成白色沉淀的量之间的关系如图: