��Ŀ����
2013���������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ��
��1��CO2�Ǵ����к�����ߵ�һ���������壬���ƺ�����CO2�ǽ������ЧӦ����Ч;����Ŀǰ����CO2���ϳɶ�������ȡ���˽ϴ�Ľ�չ���仯ѧ��Ӧ�ǣ�2CO2��g��+6H2��g��?CH3OCH3��g��+3H2O��g����H��0��
��д���÷�Ӧ��ƽ�ⳣ������ʽ ��
���жϸ÷�Ӧ��һ�������£�����㶨���ܱ��������Ƿ�ﵽ��ѧƽ��״̬�������� ��
A���������ܶȲ���
B����λʱ��������2molCO2��ͬʱ����1mol������
C��v��CO2����v��H2��=1��3
D��������ѹǿ���ֲ���
��2������β����������Ҫԭ��Ϊ��2NO��g��+2CO ��g��
2CO2 ��g��+N2 ��g��
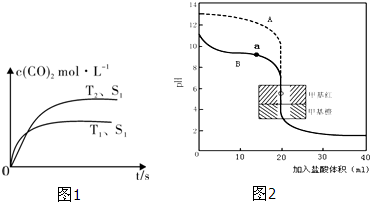
���ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯���ߣ���ͼ1��ʾ���ݴ��жϣ�
�ٸ÷�Ӧ�ġ�H 0��ѡ�����������������
�ڵ��������������һ��ʱ�����������������ѧ��Ӧ���ʣ��������ı����S1��S2����ͼ�л���c��CO2����T2��S2�����´ﵽƽ������еı仯���ߣ�
��3����֪��CO��g��+2H2��g��?CH3OH��g����H=-a kJ?mol-1��
�پ��ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
��ijʱ�̡�250���ø÷�Ӧ�ķ�Ӧ�����������Ũ��Ϊc��CO��=0.4mol?L-1��c��H2��=0.4mol?L-1��c��CH3OH��=0.8mol?L-1�����ʱv�� v�������������������=������
��ij�¶��£�������̶���2L���ܱ������н�1mol CO��2mol H2��ϣ���ò�ͬʱ�̵ķ�Ӧǰ��ѹǿ��ϵ���£�
�ﵽƽ��ʱCO��ת����Ϊ ��
��4�������Ź㷺����;��������ڻ��ʡ����ᡢ�ϳ���ά�ȹ�ҵ��������0.10mol?L-1����ֱ�ζ�20.00mL0.10mol?L-1��NaOH��Һ��20.00mL0.10mol?L-1��ˮ���õĵζ����ߣ�ͼ2�����£���ָ������ζ���ˮ������Ϊ ����A��B������д������a������Ӧ����Һ�и�����Ũ���ɴ�С������˳�� ��
��5��Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ���о���Ա���ӣ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ƣ�����ȼ��ʵ��������صķ�Ӧ�У�
4NH3��g��+3O2��g��=2N2��g��+6H2O��l����H1��
4NH3��g��+5O2��g��=4NO��g��+6H2O��l����H2��
4NH3��g��+6NO��g��=5N2��g��+6H2O��l����H3��
��д������������Ӧ�С�H1����H2����H3����֮���ϵ�ı���ʽ����H1= ��
��6������Simons�ȿ�ѧ�ҷ�����ʹNH3ֱ������ȼ�ϵ�صķ�������װ��Ϊ�ò���Ϊ�缫������������Һ�У����ط�ӦΪ 4NH3+3O2=2N2+6H2O
д����ȼ�ϵ�ص�������Ӧʽ ��

��1��CO2�Ǵ����к�����ߵ�һ���������壬���ƺ�����CO2�ǽ������ЧӦ����Ч;����Ŀǰ����CO2���ϳɶ�������ȡ���˽ϴ�Ľ�չ���仯ѧ��Ӧ�ǣ�2CO2��g��+6H2��g��?CH3OCH3��g��+3H2O��g����H��0��
��д���÷�Ӧ��ƽ�ⳣ������ʽ
���жϸ÷�Ӧ��һ�������£�����㶨���ܱ��������Ƿ�ﵽ��ѧƽ��״̬��������
A���������ܶȲ���
B����λʱ��������2molCO2��ͬʱ����1mol������
C��v��CO2����v��H2��=1��3
D��������ѹǿ���ֲ���
��2������β����������Ҫԭ��Ϊ��2NO��g��+2CO ��g��
| ���� |
���ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯���ߣ���ͼ1��ʾ���ݴ��жϣ�
�ٸ÷�Ӧ�ġ�H
�ڵ��������������һ��ʱ�����������������ѧ��Ӧ���ʣ��������ı����S1��S2����ͼ�л���c��CO2����T2��S2�����´ﵽƽ������еı仯���ߣ�
��3����֪��CO��g��+2H2��g��?CH3OH��g����H=-a kJ?mol-1��
�پ��ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
| �¶ȣ��棩 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
��ij�¶��£�������̶���2L���ܱ������н�1mol CO��2mol H2��ϣ���ò�ͬʱ�̵ķ�Ӧǰ��ѹǿ��ϵ���£�
| ʱ�䣨min�� | 5 | 10 | 15 | 20 | 25 | 30 |
| ѹǿ�ȣ�P��/Pǰ�� | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
��4�������Ź㷺����;��������ڻ��ʡ����ᡢ�ϳ���ά�ȹ�ҵ��������0.10mol?L-1����ֱ�ζ�20.00mL0.10mol?L-1��NaOH��Һ��20.00mL0.10mol?L-1��ˮ���õĵζ����ߣ�ͼ2�����£���ָ������ζ���ˮ������Ϊ
��5��Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ���о���Ա���ӣ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ƣ�����ȼ��ʵ��������صķ�Ӧ�У�
4NH3��g��+3O2��g��=2N2��g��+6H2O��l����H1��
4NH3��g��+5O2��g��=4NO��g��+6H2O��l����H2��
4NH3��g��+6NO��g��=5N2��g��+6H2O��l����H3��
��д������������Ӧ�С�H1����H2����H3����֮���ϵ�ı���ʽ����H1=
��6������Simons�ȿ�ѧ�ҷ�����ʹNH3ֱ������ȼ�ϵ�صķ�������װ��Ϊ�ò���Ϊ�缫������������Һ�У����ط�ӦΪ 4NH3+3O2=2N2+6H2O
д����ȼ�ϵ�ص�������Ӧʽ
���㣺��ѧƽ��ļ���,�ø�˹���ɽ����йط�Ӧ�ȵļ���,ԭ��غ͵��صĹ���ԭ��,�к͵ζ�
ר�⣺
��������1���ٻ�ѧƽ�ⳣ�����ڸ�����ƽ��Ũ��ϵ���η��ij˻�����Ӧ��ƽ��Ũ��ϵ���η��ij˻�֮�ȣ��ݴ���д��
�ڸ��ݻ�ѧƽ��״̬�ı�־�����淴Ӧ��������Լ���ѧƽ����������ش�
��2���ٸ��ݵ���ƽ���ʱ���ж��¶ȸߵͣ�����ƽ��ʱ������̼��Ũ���ж��¶ȶ�ƽ���Ӱ�죻
�ڽӴ����Խ��Ӧ����Խ�죬����ƽ���ʱ��Խ�̣������ı����S1��S2��S2�����´ﵽƽ������ʱ���������������Ӱ��ƽ���ƶ���ƽ��ʱ������̼��Ũ�����¶�T1����ƽ��ʱ��ͬ��
��3�������ݼ���Ũ���̺��¶��µ�ƽ�ⳣ���ȽϷ����жϷ�Ӧ���з���
���¶ȡ��������Ŀ��淴Ӧ�У������ѹǿ֮�ȵ��������ʵ���֮�ȣ��ݴ˼��㷴Ӧ��������������ʵ������Ӷ�����������Ӧ�����ʵ�����ת����=
��100%��
��4��0.10mol?L-1��NaOH��Һ��pH=13����ͼ���֪��AΪ����ζ��������Ƶ����ߣ���BΪ����ζ���ˮ�����ߣ�����a����ҺΪ�Ȼ�狀Ͱ�ˮ�Ļ����Һ����Һ�Լ��ԣ�
c��OH-����c��H+�������ɵ���غ�����������Ũ�ȵĹ�ϵ��
��5��������֪�ķ�Ӧ����˹����������������Ӧ�С�H1����H2����H3����֮���ϵ��
��6���ڱ�֤�����غ��ǰ���£������ܷ�Ӧ��ȥ������Ӧʽ�ɵø�����Ӧʽ��
�ڸ��ݻ�ѧƽ��״̬�ı�־�����淴Ӧ��������Լ���ѧƽ����������ش�
��2���ٸ��ݵ���ƽ���ʱ���ж��¶ȸߵͣ�����ƽ��ʱ������̼��Ũ���ж��¶ȶ�ƽ���Ӱ�죻
�ڽӴ����Խ��Ӧ����Խ�죬����ƽ���ʱ��Խ�̣������ı����S1��S2��S2�����´ﵽƽ������ʱ���������������Ӱ��ƽ���ƶ���ƽ��ʱ������̼��Ũ�����¶�T1����ƽ��ʱ��ͬ��
��3�������ݼ���Ũ���̺��¶��µ�ƽ�ⳣ���ȽϷ����жϷ�Ӧ���з���
���¶ȡ��������Ŀ��淴Ӧ�У������ѹǿ֮�ȵ��������ʵ���֮�ȣ��ݴ˼��㷴Ӧ��������������ʵ������Ӷ�����������Ӧ�����ʵ�����ת����=
| ������ |
| ��ʼ�� |
��4��0.10mol?L-1��NaOH��Һ��pH=13����ͼ���֪��AΪ����ζ��������Ƶ����ߣ���BΪ����ζ���ˮ�����ߣ�����a����ҺΪ�Ȼ�狀Ͱ�ˮ�Ļ����Һ����Һ�Լ��ԣ�
c��OH-����c��H+�������ɵ���غ�����������Ũ�ȵĹ�ϵ��
��5��������֪�ķ�Ӧ����˹����������������Ӧ�С�H1����H2����H3����֮���ϵ��
��6���ڱ�֤�����غ��ǰ���£������ܷ�Ӧ��ȥ������Ӧʽ�ɵø�����Ӧʽ��
���
�⣺��1���ٷ�Ӧ��2CO2��g��+6H2��g��?CH3OCH3��g��+3H2O��g����K=
���ʴ�Ϊ��K=
��
��A����Ӧ����ǰ���غ㣬ʼ�ղ��䣬������䣬�����������ܶ�ʼ�ղ��䣬���ܶȲ����ˣ���һ����ƽ�⣬��A����
B����λʱ��������2molCO2��ͬʱ����1mol�����ѣ�֤�����淴Ӧ������ȣ���B��ȷ��
C��v��CO2����v��H2��=1��3����˵�����淴Ӧ������ȣ���C����
D����Ӧ��ǰ������仯�ķ�Ӧ������������ѹǿ���ֲ��䣬֤���ﵽ��ƽ�⣬��D��ȷ��
��ѡ��BD��
��2������ͼ1��֪���¶�T1�ȵ���ƽ�⣬���¶�T1��T2���¶�Խ��ƽ��ʱ��������̼��Ũ��Խ�ͣ�˵�������¶�ƽ�����淴Ӧ�ƶ���������ӦΪ���ȷ�Ӧ����H��0���ʴ�Ϊ������
�ڽӴ����Խ��Ӧ����Խ�죬����ƽ���ʱ��Խ�̣������ı����S1��S2��S2�����´ﵽƽ������ʱ���������������Ӱ��ƽ���ƶ���ƽ��ʱ������̼��Ũ�����¶�T1����ƽ��ʱ��ͬ����c��CO2����T1��S2�����´ﵽƽ������еı仯����Ϊ�� ��
��
�ʴ�Ϊ�� ��
��
��3����250���ø÷�Ӧ�ķ�Ӧ�����������Ũ��Ϊc��CO��=0.4mol?L-1��c��H2��=0.4mol?L-1��c��CH3OH��=0.8mol?L-1��Ũ����Q=
=12.5��K=2.041��˵����Ӧ�������v����v����
�ʴ�Ϊ������
���¶ȡ��������Ŀ��淴Ӧ�У������ѹǿ֮�ȵ��������ʵ���֮�ȣ�15min��ѹǿ�ȣ�P��/Pǰ��=0.80����Ӧ����������ʵ���=3mol��0.80=2.40mol��������ٵ����ʵ���=3mol-2.4mol=0.6mol��ƽ��״̬ѹǿ�ȣ�P��/Pǰ��=0.70����Ӧ����������ʵ���=3mol��0.70=2.10mol��������ٵ����ʵ���=3mol-2.1mol=0.9mol������������ٵ����ʵ���������֮��Ĺ�ϵʽ֪�μӷ�Ӧ��CO�����ʵ���
=0.45mol����CO��ת����=
��100%=45%��
�ʴ�Ϊ��45%��
��4����0.10mol?L-1��NaOH��Һ��pH=13����ͼ���֪��AΪ����ζ��������Ƶ����ߣ���BΪ����ζ���ˮ�����ߣ�������a��pH��7��֪����Һ�Լ��ԣ�c��OH-����c��H+�����ٸ��ݵ���غ��֪��c��Cl-��+c��OH-��=c��NH4+��+c��H+������c��NH4+����c��Cl-��������������������ӣ���c��NH4+����c��Cl-����c��OH-����c��H+����
�ʴ�Ϊ��B��c��NH4+����c��Cl-����c��OH-����c��H+����
��5���ɷ�Ӧ4NH3��g��+3O2��g��=2N2��g��+6H2O��l����H1 ��
4NH3��g��+5O2��g��=4NO��g��+6H2O��l����H2 ��
4NH3��g��+6NO��g��=5N2��g��+6H2O��l����H3��
��Ӧ
�ɵõ���Ӧ�٣����H1=
���ʴ�Ϊ��
��
��6�����ܷ�Ӧ4NH3+3O2=2N2+6H2O��������ӦΪ2NH3+6OH--6e-=N2+6H2O���ɵ����غ㣬���ܷ�Ӧ����2��ȥ������Ӧ���ɵ�������Ӧʽ����O2+2H2O+4e-=4OH-���ʴ�Ϊ��O2+2H2O+4e-=4OH-��
| c(CH3OCH3)?c3(H2O) |
| c2(CO2)?c6(H2) |
| c(CH3OCH3)?c3(H2O) |
| c2(CO2)?c6(H2) |
��A����Ӧ����ǰ���غ㣬ʼ�ղ��䣬������䣬�����������ܶ�ʼ�ղ��䣬���ܶȲ����ˣ���һ����ƽ�⣬��A����
B����λʱ��������2molCO2��ͬʱ����1mol�����ѣ�֤�����淴Ӧ������ȣ���B��ȷ��
C��v��CO2����v��H2��=1��3����˵�����淴Ӧ������ȣ���C����
D����Ӧ��ǰ������仯�ķ�Ӧ������������ѹǿ���ֲ��䣬֤���ﵽ��ƽ�⣬��D��ȷ��
��ѡ��BD��
��2������ͼ1��֪���¶�T1�ȵ���ƽ�⣬���¶�T1��T2���¶�Խ��ƽ��ʱ��������̼��Ũ��Խ�ͣ�˵�������¶�ƽ�����淴Ӧ�ƶ���������ӦΪ���ȷ�Ӧ����H��0���ʴ�Ϊ������
�ڽӴ����Խ��Ӧ����Խ�죬����ƽ���ʱ��Խ�̣������ı����S1��S2��S2�����´ﵽƽ������ʱ���������������Ӱ��ƽ���ƶ���ƽ��ʱ������̼��Ũ�����¶�T1����ƽ��ʱ��ͬ����c��CO2����T1��S2�����´ﵽƽ������еı仯����Ϊ��
 ��
���ʴ�Ϊ��
 ��
����3����250���ø÷�Ӧ�ķ�Ӧ�����������Ũ��Ϊc��CO��=0.4mol?L-1��c��H2��=0.4mol?L-1��c��CH3OH��=0.8mol?L-1��Ũ����Q=
| 0.8 |
| 0.4��0��42 |
�ʴ�Ϊ������
���¶ȡ��������Ŀ��淴Ӧ�У������ѹǿ֮�ȵ��������ʵ���֮�ȣ�15min��ѹǿ�ȣ�P��/Pǰ��=0.80����Ӧ����������ʵ���=3mol��0.80=2.40mol��������ٵ����ʵ���=3mol-2.4mol=0.6mol��ƽ��״̬ѹǿ�ȣ�P��/Pǰ��=0.70����Ӧ����������ʵ���=3mol��0.70=2.10mol��������ٵ����ʵ���=3mol-2.1mol=0.9mol������������ٵ����ʵ���������֮��Ĺ�ϵʽ֪�μӷ�Ӧ��CO�����ʵ���
| 0.9mol |
| 2 |
| 0.45mol |
| 1mol |
�ʴ�Ϊ��45%��
��4����0.10mol?L-1��NaOH��Һ��pH=13����ͼ���֪��AΪ����ζ��������Ƶ����ߣ���BΪ����ζ���ˮ�����ߣ�������a��pH��7��֪����Һ�Լ��ԣ�c��OH-����c��H+�����ٸ��ݵ���غ��֪��c��Cl-��+c��OH-��=c��NH4+��+c��H+������c��NH4+����c��Cl-��������������������ӣ���c��NH4+����c��Cl-����c��OH-����c��H+����
�ʴ�Ϊ��B��c��NH4+����c��Cl-����c��OH-����c��H+����
��5���ɷ�Ӧ4NH3��g��+3O2��g��=2N2��g��+6H2O��l����H1 ��
4NH3��g��+5O2��g��=4NO��g��+6H2O��l����H2 ��
4NH3��g��+6NO��g��=5N2��g��+6H2O��l����H3��
��Ӧ
| �ڡ�3+�ۡ�2 |
| 5 |
| 3��H2+2��H3 |
| 5 |
| 3��H2+2��H3 |
| 5 |
��6�����ܷ�Ӧ4NH3+3O2=2N2+6H2O��������ӦΪ2NH3+6OH--6e-=N2+6H2O���ɵ����غ㣬���ܷ�Ӧ����2��ȥ������Ӧ���ɵ�������Ӧʽ����O2+2H2O+4e-=4OH-���ʴ�Ϊ��O2+2H2O+4e-=4OH-��
���������⿼�黯ѧƽ��ͼ��ѧ��Ӧ���ʡ�Ӱ�컯ѧƽ������ء�ƽ�ⳣ������ȣ���Ŀ�ۺ��Խϴ��ѣ��Ƕ�֪ʶ���ۺ����á�ע�����֪ʶ���������գ�

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
25��ʱ����֪����ĵ��볣����K��CH3COOH��=1.8��10-5��K1��H2CO3��=4.4��10-7��K2��H2CO3��=4.7��10-11��K��HClO��=4.0��10-8��������˵����ȷ���ǣ�������
| A��25��ʱ��0.1mol/L�Ĵ�����Һ��0.01mol/L�Ĵ�����Һ��KֵС |
| B��25��ʱ�����ȵ���0.1mol/L�Ĵ�����Һ�У���Һ�ʻ�ɫ |
| C��������ˮ��̼�����Ʋ���Ӧ |
| D�������ʵ���Ũ�ȵ�̼������Һ����������Һ������������Һ��pH��pH��Na2CO3����pH��NaClO����pH��CH3COONa�� |