题目内容
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:NH3+CO2+H2O-NH4HCO3; NH4HCO3+NaCl-NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号);
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如右图所示(图中夹持、固定用的仪器未画出).
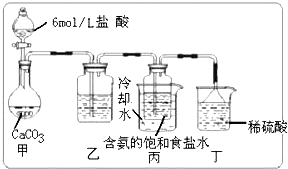
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称).
(Ⅳ)请你再写出一种实验室制取少量碳酸氢钠的方法: .
| ||
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如右图所示(图中夹持、固定用的仪器未画出).

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是
(Ⅳ)请你再写出一种实验室制取少量碳酸氢钠的方法:
考点:纯碱工业(侯氏制碱法)
专题:元素及其化合物
分析:(1)依据题干中信息碳酸氢钠溶解度相对较小分析判断;
(2)(I)依据用盐酸制取二氧化碳时常会含有氯化氢气体分析即可解答;
(II)依据稀硫酸能与氨气反应分析解答;
(III)依据分离固体与液体采用的实验操作分析解答;
(IV)从题干信息以及所学的制取碳酸氢钠的知识解答;
(2)(I)依据用盐酸制取二氧化碳时常会含有氯化氢气体分析即可解答;
(II)依据稀硫酸能与氨气反应分析解答;
(III)依据分离固体与液体采用的实验操作分析解答;
(IV)从题干信息以及所学的制取碳酸氢钠的知识解答;
解答:
解:(1)a.碳酸氢钠易溶于水,故A错误;
b.碳酸氢钠受热易分解,与其在溶液中首先结晶析出无关,故B错误;
c.碳酸氢钠的溶解度相对于氯化铵来说碳酸氢钠的溶解度更小一些,所以在溶液中首先结晶析出,故C正确;
故选C;
(2)(I)利用盐酸制取二氧化碳时,因盐酸易挥发,所以,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,故答案为:饱和碳酸氢钠溶液;
(II)实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,故答案为:吸收未反应的NH3;
(III)分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作,故答案为:过滤;
(IV)从题干信息NH4HCO3+NaCl═NaHCO3↓+NH4Cl;可得制取碳酸氢钠的方法,碳酸氢钠的溶解度小于碳酸钠,Na2CO3+CO2+H2O═2NaHCO3↓,往饱和Na2CO3 溶液中通入过量CO2 等得到碳酸氢钠,也可采用烧碱溶液中通入过量CO2,NaOH+CO2═NaHCO3,
故答案为:用碳酸氢铵与适量饱和食盐水反应(或往烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等);
b.碳酸氢钠受热易分解,与其在溶液中首先结晶析出无关,故B错误;
c.碳酸氢钠的溶解度相对于氯化铵来说碳酸氢钠的溶解度更小一些,所以在溶液中首先结晶析出,故C正确;
故选C;
(2)(I)利用盐酸制取二氧化碳时,因盐酸易挥发,所以,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,故答案为:饱和碳酸氢钠溶液;
(II)实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,故答案为:吸收未反应的NH3;
(III)分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作,故答案为:过滤;
(IV)从题干信息NH4HCO3+NaCl═NaHCO3↓+NH4Cl;可得制取碳酸氢钠的方法,碳酸氢钠的溶解度小于碳酸钠,Na2CO3+CO2+H2O═2NaHCO3↓,往饱和Na2CO3 溶液中通入过量CO2 等得到碳酸氢钠,也可采用烧碱溶液中通入过量CO2,NaOH+CO2═NaHCO3,
故答案为:用碳酸氢铵与适量饱和食盐水反应(或往烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等);
点评:本题主要考查“侯氏制碱法”的反应原理,题目较为综合,题目难度中等,解答须明晰制碱的原理.

练习册系列答案
相关题目
下列关于物质微粒的计量,正确的是(NA表示阿佛加德罗常数)( )
| A、标准状况下22.4L 氦气含有2NA个氦原子 |
| B、0.5mol/L碳酸钠溶液中,CO32-小于0.5NA |
| C、0.1mol OH-含NA个电子 |
| D、1.8g重水(D2O)中含NA个中子 |
取少量无机盐溶液试样,对其中的离子进行检验,下列判断正确的是( )
| A、加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定含CO32- |
| B、加入KSCN溶液,无明显现象,再滴加几滴新制氯水,溶液变为血红色,则试样中一定含Fe2+ |
| C、加入BaCl2溶液,产生白色沉淀,再加入过量的稀盐酸酸化,沉淀不溶解,则试样中一定含SO42- |
| D、在酒精灯火焰上灼烧,火焰为黄色,则试样中一定含钠元素,一定不含钾元素 |
下列关于离子检验的说法正确的是( )
| A、可以用NaOH溶液来检验FeCl3溶液中混有的Fe2+ |
| B、受NH4+检验方法的启发,可以通过将NO3-转化成NO的方式来检验 |
| C、取待测液于试管中,先加稀硝酸酸化,再加Ba(NO3)2溶液,若产生白色沉淀,则待测液中一定有SO42- |
| D、取待测液于试管中,加入足量的稀盐酸,若产生使澄清石灰水变混浊的无色无味气体,则待测液中一定有大量CO32- |
