题目内容
24.5g H2SO4的物质的量是 mol,1.50molNa2CO3的质量是 克.
考点:物质的量的相关计算
专题:
分析:根据n=
计算硫酸的物质的量;根据m=nM计算碳酸钠的质量.
| m |
| M |
解答:
解:硫酸的摩尔质量为98g/mol,24.5g H2SO4的物质的量是
=0.25mol;
碳酸钠的摩尔质量为106g/mol,1.50mol Na2CO3的质量是1.5mol×106g/mol=159g,
故答案为:0.25;159.
| 24.5g |
| 98g/mol |
碳酸钠的摩尔质量为106g/mol,1.50mol Na2CO3的质量是1.5mol×106g/mol=159g,
故答案为:0.25;159.
点评:本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算公式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
一定量的金属 Cu完全溶于适量浓硝酸中,收集到混合气体(含NO、N2O4、NO2)共0.9mol.将上述气体平均分为两份,一份与标准状况下4.48LO2混合后,用水吸收,无气体剩余;另一份恰好能被500mL 1mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,则其中NaNO3的物质的量为( )
| A、0.25mol |
| B、0.2mol |
| C、0.15mol |
| D、0.1mol |
某盐的混合物中含有0.2mol Na+、0.4mol Mg2+、0.1mol Cl- 和 SO42-,则其含SO42-的物质的量为( )
| A、0.1mol |
| B、0.3mol |
| C、0.5mol |
| D、0.45mol |
已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则ω g R原子完全转化为R2-时,含有电子的物质的量是( )
A、
| ||
B、
| ||
C、ω(
| ||
D、ω(
|
设阿伏加德罗常数为NA,下列说法正确的是( )
A、标准状况下,VL辛烷所含分子数为
| ||
| B、1.5 mol NO2与足量H2O反应,转移的电子数为nA | ||
| C、常温常压下,0.2mol的SiO2所含分子数为0.2NA | ||
D、31g白磷(P4)中含有
|
下列说法错误的是( )
| A、NH4NO3溶于水是自发过程 |
| B、同一种物质气态时熵值最大,液态时次之,而固态时最小 |
| C、借助于外力能自发进行的过程,其体系的能量趋向于从高能状态转变为低能状态 |
| D、由能量判据(以焓变为基础)和熵判据组合而成的复合判据,更适合于所有的过程 |
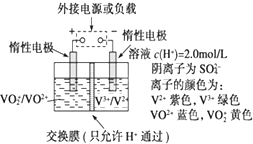 全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.
全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示. 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.