题目内容
2.浓硫酸具有的性质:( )①脱水性 ②吸水性③强氧化性 ④强酸性 ⑤高沸点.
| A. | 只有①③⑤ | B. | 只有②③④ | C. | 只有③④⑤ | D. | ①②③④⑤均有 |
分析 依据浓硫酸具有吸水性、脱水性、强的氧化性、强酸性、沸点高的性质解答.
解答 解:浓硫酸是一种高沸点强酸,具有难挥发性、吸水性、脱水性、强的氧化性、强酸性,
故选:D.
点评 本题考查了元素化合物知识,熟悉浓硫酸的性质是解题关键,侧重考查学生对基础知识掌握熟练程度,题目简单.

练习册系列答案
相关题目
12. 不能实现如图转化的单质甲是( )
不能实现如图转化的单质甲是( )
 不能实现如图转化的单质甲是( )
不能实现如图转化的单质甲是( )| A. | Si | B. | S | C. | Fe | D. | Cu |
7.医生给病人输液,液体里含的糖指的是( )
| A. | 麦芽糖 | B. | 葡萄糖 | C. | 蔗糖 | D. | 淀粉 |
14.有相同质子数的微粒一定是( )
| A. | 同种元素 | B. | 同种分子 | C. | 同种原子 | D. | 不能确定 |
11.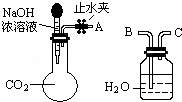 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶),反应的离子方程式是2OH-+CO2=CO32-+H2O(或CO2+OH-=HCO3-).若其它操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口有气泡产生.
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3g白色固体,该白色固体的组成是NaOH和Na2CO3(写化学式).
设计实验确认该白色固体中存在的阴离子,试完成下列方案.
(3)在标况下,将4.48L CO2气体通入300mL 1mol/L 的NaOH的稀溶液中,写出该反应的离子方程式(用一个离子方程式表示)2CO2+3OH-=CO32-+HCO3-+H2O.
 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶),反应的离子方程式是2OH-+CO2=CO32-+H2O(或CO2+OH-=HCO3-).若其它操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口有气泡产生.
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3g白色固体,该白色固体的组成是NaOH和Na2CO3(写化学式).
设计实验确认该白色固体中存在的阴离子,试完成下列方案.
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | 产生白色沉淀 | 有CO32- |
| ②过滤,取2mL滤液于试管中 | ||
| ③滴加酚酞 | 溶液变红 | 有OH- |
12.下列叙述中,不正确的是( )
| A. | 钠原子有强还原性,钠离子有弱氧化性 | |
| B. | 钠离子浓度大的溶液一定显碱性 | |
| C. | 由于钠很活泼,所以一定能从溶液中置换出金属活动性顺序表中钠后面的金属 | |
| D. | 钠是电和热的良导体 |