题目内容
19.某无色澄清透明的溶液中可能含有下列离子:K+、Cu2+、Ba2+、Al3+、NH4+、Mg2+、Cl-、CO32-、SO42-现做以下实验:①将溶液滴在蓝色石蕊试纸上,试纸呈红色;②取少量溶液,加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀;③将②中的沉淀过滤.向滤液中加入硝酸银溶液,产生白色沉淀;④另取该溶液,逐滴加入氢氧化钠溶液至过量,无气体产生,观察到有白色沉淀生成,且沉淀部分溶解.由此可以推断:(1)溶液中肯定存在的离子有:SO42-、Al3+、Mg2+ (填离子符号,错选扣分,下同)
(2)溶液中肯定不存在的离子有:Ba2+、CO32-、Cu2+、NH4+.
(3)溶液中不能确定是否存在的离子有:K+、Cl-
(4)写出②中发生反应的离子反应方程式:Ba2++SO42-=BaSO4↓.
分析 ①用蓝色石蕊试纸检测该溶液,试纸显红色,说明溶液呈酸性,则一定不存在CO32-;
②取溶液少许,加入用稀HNO3酸化的BaCl2溶液,产生白色沉淀,该沉淀为硫酸钡沉淀,说明含有SO42-,则一定不含有Ba2+;
③取实验②后的澄清溶液,滴入硝酸银溶液产生白色沉淀,沉淀不消失,不能证明是否含有Cl-离子,因②中加入氯化钡;
④取溶液少许,逐滴加入NaOH溶液至过量,无气体生成,说明一定不含NH4+,有白色沉淀产生且沉淀部分溶解,说明不含Cu2+,一定含有Al3+和Mg2+,以此来解答.
解答 解:①用蓝色石蕊试纸检测该溶液,试纸显红色,说明溶液呈酸性,则一定不存在CO32-;
②取溶液少许,加入用稀HNO3酸化的BaCl2溶液,产生白色沉淀,该沉淀为硫酸钡沉淀,说明含有SO42-,则一定不含有Ba2+;
③取实验②后的澄清溶液,滴入硝酸银溶液产生白色沉淀,沉淀不消失,不能证明是否含有Cl-离子,因②中加入氯化钡;
④取溶液少许,逐滴加入NaOH溶液至过量,无气体生成,说明一定不含NH4+,有白色沉淀产生且沉淀部分溶解,说明不含Cu2+、Fe3+,一定含有Al3+和Mg2+.
(1)依据分析可知:溶液中一定存在:SO42-、Al3+和Mg2+,故答案为:SO42-、Al3+、Mg2+;
(2)一定不存在:Ba2+、CO32-、Cu2+、NH4+,故答案为:Ba2+、CO32-、Cu2+、NH4+;
(3)不能确定的离子是:K+、Cl-,故答案为:K+、Cl-;
(4)②中钡离子与硫酸根反应生成硫酸钡沉淀,离子反应方程式为:Ba2++SO42-=BaSO4↓,故答案为:Ba2++SO42-=BaSO4↓.
点评 本题考查离子的推断,为高频考点,把握离子的颜色、离子之间的反应为解答的关键,侧重分析、推断能力的综合考查,题目难度不大.

| A. | Fe和盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 石灰石和盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
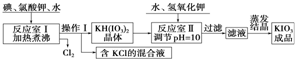
请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:②除去反应生成的氯气,有利于反应正反应方向进行
(请从化学平衡角度解释).
(3)已知几种物质的溶解度见下表:
| KCl | KH(IO3)2 | KClO3 | |
| 溶解度g/100g水(25℃) | 20.8 | 0.8 | 7.5 |
| 溶解度g/100g水(80℃) | 37.1 | 12.4 | 16.2 |
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是使KH(IO3)2转化为KIO3.
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0mol•L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00mL,则成品中KIO3的质量分数为85.6%(列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,I2+2Na2S2O3═2NaI+Na2S4O6).
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
②根据乙同学的实验结果推测,甲同学的实验结果会偏大(填“偏大”,“偏小”或“无影响”).
| A. | CO2与SO2 | B. | CH4与NH3 | C. | SO3与BF3 | D. | H2S与CCl4 |
| A. | 18O 31P 35Cl | B. | 27Al 19F 12C | ||
| C. | 第一周期所有元素的原子 | D. | 元素周期表中ⅤA所有元素的原子 |
| A. | 铝粉投入到NaOH溶液中:2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑ | |
| B. | 往Al(OH)3中滴加氨水:Al(OH)3+OH-=[Al(OH)4]- | |
| C. | 向水玻璃中通入少量二氧化碳:SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| D. | Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-+3H2O=2[Al(OH)4]- |
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5 NA | |
| B. | 26g乙炔所含共价键数目为2 NA | |
| C. | 标准状况下,11.2 L CCl4所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
| A. | 核外有25个电子 | |
| B. | 是一种新元素 | |
| C. | 核内有15个质子,核外有10个电子 | |
| D. | 质量数为25,原子序数为15,核内有10个中子 |
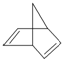 ,其分子式为C7H8.
,其分子式为C7H8. .
.