题目内容
8.100mL 1mo1•L-1的HCl溶液中HCl的物质的量浓度1mol/L,HCl物质的量为0.1mol.分析 根据n=cV计算.
解答 解:c(HCl)=1mol/L,n(HCl)=0.1L×1mol/L=0.1mol.
故答案为:1mol/L;0.1mol.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,难度不大,注意相关计算公式的运用.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
16.将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )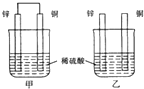

| A. | 两烧杯中溶液的pH均增大 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中铜片表面均无气泡产生 | D. | 甲、乙溶液均变蓝色 |
3.在水溶液中能大量共存,且加入过量稀硫酸溶液时,有气体生成的是( )
| A. | Na+ Ag+ CO32- Cl- | B. | K+ Ba2+SO42- Cl- | ||
| C. | Na+ K+ CO32- Cl- | D. | Na+ K+ Cl- SO42- |
6.Ca(OH)2溶解度随温度变化曲线如图所示,下列说法正确的是( )


| A. | 氢氧化钙的溶解是吸热过程 | |
| B. | 温度升高时氢氧化钙溶解的速度减慢 | |
| C. | t℃时氢氧化钙的 Ksp约等于2.46×10-6 | |
| D. | 向只含有Ca(OH)2 和Mg(OH)2]两种沉淀的悬浊液中滴加NaOH浓溶液,分散系中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$比值不变 |

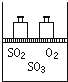 如图,将4mol SO2和2mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.试回答:
如图,将4mol SO2和2mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.试回答:

 ;水杨酸与小苏打溶液反应的化学方程式:
;水杨酸与小苏打溶液反应的化学方程式: ;
; .
.