题目内容
19.二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe2O
3,该反应中被氧化的元素是Fe,S(填元素符号).当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为11.2L.
(2)实验室中用下列装置测定SO2催化氧化为SO3,的转化率.(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加.
②实验过程中,需要通入氧气.试写出一个用图1所示装置制取氧气的化学方程式2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是使残留在装置中的二氧化硫和三氧化硫被充分吸收.
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是$\frac{\frac{m}{80}}{\frac{m}{80}+\frac{n}{233}}$×100%用含字母的代数式表示,不用化简).
(3)某学习小组设计用如图2装置验证二氧化硫的化学性质.
①能说明二氧化硫具有氧化性的实验现象为试管a中出现淡黄色浑浊.
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是Ⅲ(填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-.
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
分析 (1)氧化还原反应中,化合价升高的元素在反应中被氧化,根据电子守恒确定转移电子的量与二氧化硫的量之间的关系;
(2)浓硫酸和亚硫酸钠反应生成二氧化硫,含有水蒸气,通过浓硫酸干燥后通过催化剂的玻璃管,发生反应生成三氧化硫,进入装置D冷却得到三氧化硫,最后通过足量的硝酸钡溶液吸收过滤的二氧化硫,
①根据分液漏斗的使用方法来回答;
②氯酸钾受热分解可以获得氧气;
③为确保实验的准确度,要保证二氧化硫和三氧化硫的量的测定准确;
④根据质量守恒以及转化率=$\frac{消耗量}{起始量}$×100%来计算;
(3)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应;
②氯气具有氧化性,可以将二氧化硫氧化到最高价的硫酸;
③根据溶液中的电荷守恒来回答.
解答 解:(1)氧化还原反应4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe2O3中,化合价升高的Fe、S元素在反应中被氧化,该反应生成8mol的二氧化硫,转移电子的物质的量为44mol,所以当该反应转移2.75mol电子时,生成的二氧化硫的物质的量为0.5mol,在标准状况下的体积为11.2L,故答案为:Fe、S;11.2;
(2)①分液漏斗的使用方法:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加,故答案为:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加;
②氯用图2所示装置制取氧气,即加热固体的方法制氧气,可以让氯酸钾在二氧化锰催化下受热分解获得氧气,方程式为:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,
故答案为:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑;
③为确保实验的准确度,要保证二氧化硫和三氧化硫的量的测定准确,当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,可以让装置中的二氧化硫和三氧化硫充分被后面的装置吸收,故答案为:使残留在装置中的二氧化硫和三氧化硫被充分吸收;
④装置D增加的质量为mg,及生成三氧化硫的质量是mg,物质的量是$\frac{mg}{80g/mol}$,装置E中产生白色沉淀的质量为ng,则吸收的二氧化硫的物质的量是$\frac{ng}{233g/mol}$,则二氧化硫的转化率=$\frac{\frac{m}{80}}{\frac{m}{80}+\frac{n}{233}}$×100%,
故答案为:$\frac{\frac{m}{80}}{\frac{m}{80}+\frac{n}{233}}$×100%;
(3)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应,生成淡黄色的沉淀S,故答案为:试管a中出现淡黄色浑浊;
②方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去,可以是氯水中含有的漂白性物质次氯酸起的作用;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液汇总出现硫酸根离子,是二氧化硫在酸性环境下和氯水反应生成的,即SO2+Cl2+2H2O=4H++SO42-+2Cl-,
Ⅲ合理,二氧化硫被氧化生成硫酸根离子,和钡离子反应生成白色沉淀,据此能证明二氧化硫的还原性;氯气和二氧化硫 发生氧化还原反应生成硫酸和盐酸,离子方程式为:SO2+Cl2+2H2O=4H++SO42-+2Cl-,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
③将二氧化硫通入到盛有氢氧化钠的试管c中,所得溶液中存在电荷守恒:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显示中性,所以c(H+)=c(OH-),此时:c(Na+)=2c(SO32-)+c(HSO3-),
故答案为:2c(SO32-)+c(HSO3-).
点评 本题考查了二氧化硫性质应用和实验验证,实验设计的步骤和实验方案的确定应根据题干要求分析判断,关键是读懂题干信息,依据题干条件计算判断,题目较难.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
| A. | a挥发、b吸水 | B. | a升华、b冷凝 | C. | a蒸发、b潮解 | D. | a冷凝、b吸水 |
| A. | Al3+Na+HCO3- Cl- | B. | K+ Na+ HCO3-AlO2- | ||
| C. | Mg2+ NH4+ SO42-Cl- | D. | Fe2+ Na+Cl- NO3- |
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 88g乙酸乙酯中存在的共价键总数为14NA | |
| C. | 加热时,含2molH2SO4的浓硫酸与足量铜反应,转移的电子数为2NA | |
| D. | 1mol羟基所含的电子数为10NA |
| A. | 钠浮在水面上 | B. | 钠熔化成小球并在水面上游动 | ||
| C. | 有无色无味的气体生成 | D. | 水溶液变为红色 |
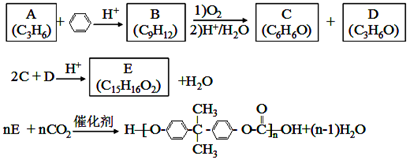
 ;D有多种同分异构体,其中含有醛基的是CH3CH2CHO.按官能团分类E为酚.
;D有多种同分异构体,其中含有醛基的是CH3CH2CHO.按官能团分类E为酚.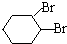 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$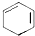 +2NaBr+2H2O.
+2NaBr+2H2O.