题目内容
1.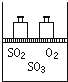 如图,将4mol SO2和2mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.试回答:
如图,将4mol SO2和2mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.试回答:(1)在该平衡状态时n(SO3)=3.6;
(2)若起始时加入1.2mol SO2、0.6mol O2和x mol SO3,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的取值为≥0的任意值;
(3)若反应开始时的v(逆)>v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol.则起始时n(SO3)的取值范围是3.6<c≤4.
分析 (1)依据化学平衡三段式列式计算,设生成三氧化硫物质的量为2x,根据平衡时混合气体总物质的量为2.4mol列式计算得到三氧化硫物质的量;
(2)等压容器中,若起始时a=1.2mol,b=0.6mol,a:b=2:1,等于起始时加入的2mol SO2和1mol O2的量的比值,二者建立的平衡一定为等效平衡;
(3)起始时,若SO2和O2的量均为0,则c值最大,利用一边倒,完全转化为SO2和O2的量分别为2mol和1mol,C为2mol;根据(1)计算平衡时SO3的量为1.2mol,则c值应该大于1.2.
解答 解:(1)设反应达到平衡时生成三氧化硫物质的量为2x,
2SO2(g)+O2(g) $\frac{\underline{催化剂}}{△}$2SO3(g),△H<0
起始(mol) 4 2 0
变化(mol) 2x x 2x
平衡(mol) 4-2x 2-x 2x
(4-2x)+(2-x)+2x=4.2
x=1.8mol 则n(SO3)=3.6 mol,
故答案为:1.2mol;
(2)等压容器中,若起始时1.2mol SO2、0.6mol O2和x mol SO3,二氧化硫和氧气的物质的量之比是2:1,等于起始时加入的:4mol SO2和2mol O2的量的比值,反应2SO2(g)+O2(g)?2SO3(g)△H<0产物只有三氧化硫,无论三氧化硫的量为多少,利用一边倒的方法,转化为二氧化硫和氧气的量之比均为2:1,二者建立的平衡一定为等效平衡,故达到平衡后各气体的体积分数与平衡状态A相同,
故答案为:≥0的任意值;
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,三氧化硫最小值为(1)中平衡时三氧化硫的物质的量,即大于3.6mol,c值最大时,SO2和O2的量均为0,利用一边倒,完全转化为SO2和O2的量分别为4mol和2mol,C应为4mol,故3.6<c≤4,故答案为:3.6<c≤4.
点评 本题考查了等效平衡的判断与利用,题目难度较大,试题培养了学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 88g乙酸乙酯中存在的共价键总数为14NA | |
| C. | 加热时,含2molH2SO4的浓硫酸与足量铜反应,转移的电子数为2NA | |
| D. | 1mol羟基所含的电子数为10NA |
| A. | 0.2 mol | B. | 0.25 mol | C. | 0.3 mol | D. | 0.35 mol |

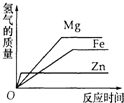
已知各相关氢氧化物沉淀pH范围如下表所示:
| Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
| 完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要D(选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤Ⅱ中通过加入KMnO4的作用是MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O(用离子方程式表示);
(3)用ZnO调节pH,可以除去含铁杂质.检验Fe3+是否沉淀完全的实验操作是取少量溶液,滴加KSCN溶液,无颜色变化,说明沉淀完全,反应沉淀不完全,调节pH的适宜范围是4.1~4.7;
(4)步骤Ⅲ中加入Zn粉的作用是:①除去溶液中的Cu2+;②进一步调节溶液pH;
(5)步骤IV中使用热NH4HCO3溶液能促进Zn2+转化为沉淀,但温度不宜过高,其原因可能是NH4HCO3分解导致损失.
(6)用如下方法测定所得活性氧化锌的纯度:
①取1.000g活性氧化锌,用15.00mL 1.000mol/L硫酸溶液完全溶解,滴入几滴甲基橙,
②用浓度为0.500mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL.
判断滴定终点的方法是溶液颜色由红色变为黄色,且半分钟不变色,所得活性氧化锌的纯度为97.2%;
(7)已知常温下,CuS的溶度积常数Ksp=6.0×10-36,物质的量浓度为3.0×10-3mol•L-1Na2S溶液与等体积的CuSO4溶液中混合后立即产生沉淀,则CuSO4的浓度最小为4.0×10-33mol•L-1.