题目内容
13.下列说法正确的是( )| A. | 在CCl4、PCl5、CS2分子中所有原子都满足最外层为8个电子稳定结构 | |
| B. | 三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,因此三氯化铁晶体是离子晶体 | |
| C. | Na3N与NaH均为离子化合物,都能与水反应放出气体,且与水反应所得溶液均能使酚酞试液变红 | |
| D. | SO2、H2O都是由极性键形成的非极性分子 |
分析 A、对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,据此判断;
B、熔沸点低的晶体一般属于分子晶体;
C、Na3N和水反应生成氢氧化钠,NaH和水反应生成氢氧化钠,无色酚酞试液遇碱变红色;
D、SO2中含S=O极性键,为V型分子,属于极性分子,H2O中含H-O极性键,为V型分子,属于极性分子.
解答 解:A、PCl5中P元素化合价为+5价,P原子最外层电子数是5,5+5=10,则P原子不满足8电子结构,故A错误;
B、三氯化铁常温下为固体,熔点282℃,沸点315℃,300℃以上易升华,熔沸点低为分子晶体,故B错误;
C、氮化钠和水反应生成氢氧化钠和氨气,氢化钠和水反应生成氢氧化钠和氢气,所以反应后的溶液都呈碱性,无色酚酞试液遇碱变红色,故C正确;
D、SO2中含S=O极性键,为V型分子,属于极性分子,H2O中含H-O极性键,为V型分子,属于极性分子,故D错误;
故选C.
点评 本题考查较综合,涉及化学键和晶体的考查,把握化学键的形成及晶体的判断、晶体熔沸点的比较、分子极性的判断等为解答的关键,注重高频考点的考查,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
3.下列物质的晶体中,既含有离子键,又含有极性共价键的是( )
| A. | NaOH | B. | Na2O2 | C. | CaCl2 | D. | H2O2 |
4.已知向某溶液中逐滴加入NaOH溶液时,测得生成沉淀的质量随所加入NaOH的体积变化如图所示,则该溶液中大量含有的离子可能是( )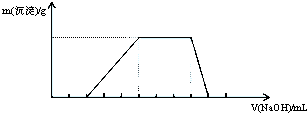

| A. | H+、Al3+、AlO2-、SO42- | B. | H+、NH4+、Al3+、NO3- | ||
| C. | H+、NH4+、Mg2+、Cl- | D. | NH4+、Al3+、Cl-、SO42- |
1.下列说法一定正确的是(NA表示阿伏加德罗常数)( )
| A. | 常温下4.4gN2O与标准状况下2.24LCH4均含有0.1NA个分子 | |
| B. | 78g金属钾(K)完全转化为超氧化钾(KO2)时,转移电子数为4NA | |
| C. | 0.1mol/L稀盐酸中,H+数目为0.1NA | |
| D. | 60g二氧化硅晶体中,含S-O键数目为2NA |
8.下列有关元素的性质及其递变规律正确的是( )
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子还原性越强,对应单质的氧化性越强 | |
| D. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
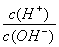 =1×10-12的溶液:K+、AlO2—、CO32—、Na+、Cl-
=1×10-12的溶液:K+、AlO2—、CO32—、Na+、Cl-