��Ŀ����
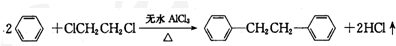
7��������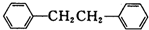 ����һ����Ҫ���л��ϳ��м��壬ʵ���ҿ��ñ���1��2-�������飨ClCH2CH2Cl��Ϊԭ�ϣ�����ˮAlCl3���¼����Ƶã�����ȡ����Ϊ��
����һ����Ҫ���л��ϳ��м��壬ʵ���ҿ��ñ���1��2-�������飨ClCH2CH2Cl��Ϊԭ�ϣ�����ˮAlCl3���¼����Ƶã�����ȡ����Ϊ����һ���������Ʊ�
��ͼ��ʵ������ȡ������ˮAlCl3�����ʵ��װ�õ�������ҩƷ
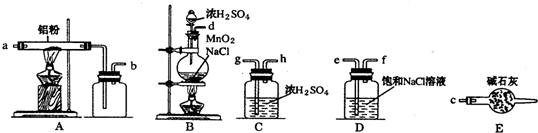
��1���������������ӳ�һ���Ʊ���������ˮAlCl3��װ�ã����ܿڱ������˳��Ϊ��d��e��f��g��h��a��b��c��
��2�����˽��齫����װ����Dȥ��������װ�ú��Լ����䣬Ҳ���Ʊ���ˮAlCl3������Ϊ�Ƿ���в����� ������С������С���������������Ƶõ�Cl2�л��е�HCl��Al��Ӧ����H2��H2��Cl2��ϼ���ʱ�ᷢ����ը��
��3��װ��A��������һ�ְ��������������һ�ָĽ���������Ӳ�ʲ���������ƿ֮���ôֵ������ӣ���ֹAlCl3�����ɹ�����ɶ�����
�������������Ʊ�
��������ȡԭ��Ϊ��
��Ӧ�������Ϊn��������n��1��2-�������飩=10��1����Ӧ�¶���60-65��֮�䣮ʵ������ȡ������װ����ͼ��ʾ�����Ⱥͼӳ�������ȥ��
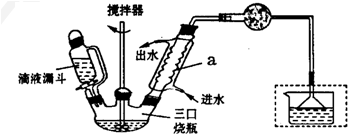
ʵ�鲽�裺
��������ƿ�м���120.0mL����������ˮAlCl3���ɵ�Һ©���μ�10.7 mL 1��2-�������飬���Ʒ�Ӧ�ٶ���60-65�棬��ӦԼ60 min������Ӧ��Ļ�����������ϡ���ᡢ2% Na2CO3��Һ��H2Oϴ�ӷ��룬�����ò����м���������ˮMgSO4���壬��ֹ�����ˣ��ȳ�ѹ�����ڼ�ѹ�����ռ�170〜172�����֣�������18.2 g��
������������������������
| ���� | ��Է������� | �ܶ�/��g•cm-1�� | �۵�/�� | �е�/�� | �ܽ��� |
| �� | 78 | 0.88 | 5.5 | 80.1 | ����ˮ�������Ҵ� |
| 1��2-�������� | 99 | 1.27 | -35.3 | 83.5 | ����ˮ�����ܱ� |
| ��ˮ�Ȼ��� | 133.5 | 2.44 | 190 | 178�������� | ��ˮˮ�⣬�ܱ� |
| ���� | 182 | 0.98 | 52 | 284 | ����ˮ�����ܱ� |
��5��ϴ�Ӳ����У�ˮϴ��Ŀ����ϴ��Na2CO3����ϴ���������������ˮ����þ����������ˮ�������������
��6����ѹ����ʱ����Ϳ����¶���83.5�森
��7����ʵ��IJ���ԼΪ72.85% ��С���������λ��Ч���֣���
���� ��1������ʵ��װ��ͼ��֪����ʵ������Ũ������������̷�Ӧ�������������������Ȼ��⡢ˮ�����ʣ����ñ���ʳ��ˮ���Ȼ��⣬����Ũ����������������Ӧ�Ƶ��Ȼ�������Ӧ��β�������������գ�Ϊ��ֹ�Ȼ���������������Һ�е�ˮ������Ӧ��������Ҫ���β������װ�ã�
��2������HCl��Al��Ӧ����H2��H2��Cl2��ϼ���ʱ�ᷢ����ը��������
��3��AlCl3�����ɹ��������Թܶ������ݴ˻ش�
��4������ʵ���������ص���ȷ�������ƣ����Һ��©������ͨ��Һ©�����ص��Լ�ʹ��ԭ�����ش�
��5��ϴ�Ӳ����У��ڶ���ˮϴ��Ҫ�dz�ȥ�Ȼ����������̼���ƣ���ϴ�������������ϴ�Ӻ����������ˮ����þ���壬Ŀ�������ղ�Ʒ��������ˮ�֣�Ҳ�������Ȼ��ƴ��棻
��6����ѹ���ɽ��ͷе㣬����ʵ��Ŀ���Լ����ʵ��۷е����ش�
��7��120mL�����ܶ�0.88g/mL�������ʵ���Ϊ$\frac{120��0.88}{78}$mol=1.35mol��10.2mL1��2-������������ʵ���Ϊ$\frac{10.7��1.27}{99}$mol=0.137mol�����ݱ���1��2-��������Ϊԭ���Ʊ������ķ���ʽ��֪�������������Բ�Ʒ�����۲���Ϊ0.137mol��182g/mol=24.98g�����ݲ���=$\frac{ʵ�ʲ���}{���۲���}$��100%���㣮
��� �⣺��1�������Ʊ���ˮ�Ȼ�������Ҫ����ȡ��������2װ�ã���������3���ڳ�ȥ�����е��Ȼ��⣬4���ڸ���������������ˮ�Ȼ�������ʪ����������ˮ����FeCl3•nH2O������5��ֹ�����е�ˮ�������룬ͬʱ����δ��Ӧ����������ֹ��Ⱦ������������������˳��Ϊd��e��f��g��h��a��b��c��
�ʴ�Ϊ��f��g��h��a��b��c��
��2��������װ����Dȥ��������װ�ú��Լ����䣬�����Ʊ���ˮAlCl3����Ϊ�Ƶõ�Cl2�л��е�HCl��Al��Ӧ����H2��H2��Cl2��ϼ���ʱ�ᷢ����ը��
�ʴ�Ϊ�������У��Ƶõ�Cl2�л��е�HCl��Al��Ӧ����H2��H2��Cl2��ϼ���ʱ�ᷢ����ը��
��3��Ϊ�˷�ֹAlCl3�����ɹ��������Թܶ�������Ӳ�ʲ���������ƿ֮���ôֵ������ӣ��ʴ�Ϊ����Ӳ�ʲ���������ƿ֮���ôֵ������ӣ���ֹAlCl3�����ɹ�����ɶ�����
��4������ʵ���������ص㣬֪����װ�õ������ǣ����������ܣ�����ͨ��Һ©����ȣ�ʹ�õ�Һ©�����ŵ��ǿ���ʹҺ��˳�����£�
�ʴ�Ϊ�����������ܣ�����ʹҺ��˳�����£�
��5��ϴ�Ӳ����У��ڶ���ˮϴ��Ҫ�dz�ȥ�Ȼ����������̼���ƣ���ϴ�������������ϴ�Ӻ����������ˮ����þ���壬Ŀ�������ղ�Ʒ��������ˮ�֣�Ҳ�������Ȼ��ƴ��棬����ˮ�������������
�ʴ�Ϊ��ϴ��Na2CO3����ϴ���������������ˮ�������������
��6����ѹ����ʱ����ѹ���ɽ��ͷе㣬�����¶ȹ��ߣ����¸���Ӧ�ķ������������ʵ��۷е�ĸߵͣ���Ҫ��Ϳ����¶���83.5�棬�ʴ�Ϊ��83.5�棻
��7��120mL�����ܶ�0.88g/mL�������ʵ���Ϊ$\frac{120��0.88}{78}$mol=1.35mol��10.2mL1��2-������������ʵ���Ϊ$\frac{10.7��1.27}{99}$mol=0.137mol�����ݱ���1��2-��������Ϊԭ���Ʊ������ķ���ʽ��֪�������������Բ�Ʒ�����۲���Ϊ0.137mol��182g/mol=24.98g������=$\frac{ʵ�ʲ���}{���۲���}$��100%=$\frac{28.2g}{24.98g}$��100%=72.85%���ʴ�Ϊ��72.85%��
���� ���⿼���Ʊ�ʵ�鷽����ƣ�Ϊ��Ƶ���㣬��Ŀ�Ѷ��еȣ�������ѧ���ķ�����ʵ�������Ŀ��飬��ȷԭ���ǽ���ؼ���ע�������ػ���ʵ�鷽���Ͳ����İ��գ�

 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�2IO3-+5SO32-+2H+�TI2+5SO42-+H2O�����ɵĵ�����õ�����Һ���飬���ݷ�Ӧ��Һ������ɫ�����ʱ���������÷�Ӧ�����ʣ�ijͬѧ���ʵ�������ʾ��
| 0.01mol•L-1 KIO3������Һ�������ۣ������/mL | 0.01mol•L-1 Na2SO3��Һ�����/mL | H2O����� /mL | ʵ�� �¶� /�� | ��Һ������ɫʱ����ʱ��/s | |
| ʵ��1 | 5 | V1 | 35 | 25 | |
| ʵ��2 | 5 | 5 | 40 | 25 | |
| ʵ��3 | 5 | 5 | V2 | 0 |
| A�� | ƽ����ϵ�е������������������ʵ������ֲ��� | |
| B�� | ƽ����ϵ�е���������������Ũ�ȱ��ֲ��� | |
| C�� | ��λʱ�������ɵİ��ͷֽ�İ����ʵ�����ͬ | |
| D�� | ��λʱ�������ĵĵ��������������ɵİ������ʵ�����ͬ |
��CH4���ӵı���ģ�ͣ�

�����Ȼ�̼���ӵĵ���ʽΪ��
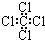
����ϩ�Ľṹ��ʽ CH2CH2
�ܱ�����ӵ����ģ��
| A�� | �٢� | B�� | �٢ڢ� | C�� | �٢ڢۢ� | D�� | �ڢ� |
| A�� | �е��ɸߵ��ͣ�HF��HCl | B�� | �۵��ɸߵ��ͣ�K��Li | ||
| C�� | Ӳ���ɴ�С�����ʯ������� | D�� | �������ɴ�С��NaF��NaCl |

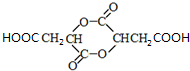 ��
��  ��
��
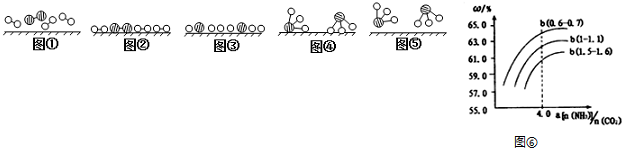
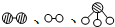 �ֱ��ʾN2��H2��NH3��ͼ�ݱ�ʾ���ɵ�NH3�뿪�������棬ͼ�ں�ͼ�۵ĺ���ֱ���N2��H2�������ڴ������桢�ڴ�������N2��H2�л�ѧ�����ѣ�
�ֱ��ʾN2��H2��NH3��ͼ�ݱ�ʾ���ɵ�NH3�뿪�������棬ͼ�ں�ͼ�۵ĺ���ֱ���N2��H2�������ڴ������桢�ڴ�������N2��H2�л�ѧ�����ѣ�