题目内容
4. A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C(1)若A是一种活泼金属,C是淡黄色固体,用化学方程式表示C物质与水的反应2Na2O2+2H2O═4NaOH+O2↑.将C长期露置于空气中,最后将变成物质D,D的化学式为Na2CO3.现在有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为83.2%.
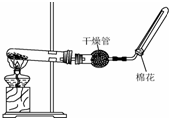
(2)若C是红棕色气体.如图是实验室制取A气体的装置:
①写出实验室制取A的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②图中干燥管内可能盛放的物质是bc.
a.浓硫酸 b.生石灰 c.碱石灰 d.五氧化二磷
③检验A是否集满的方法是将湿润的红色石蕊试纸放于试管口,试纸变蓝(或将沾有浓盐酸的玻璃棒放于试管口,产生白烟).工业上用A制取B反应的化学方程式4 NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 (1)A是一种活泼金属,C是淡黄色固体,则A为Na,X为O2,B为Na2O,C为Na2O2,过氧化钠长期露置于空气中,过氧化钠和水反应生成NaOH,而NaOH和二氧化碳反应生成碳酸钠,过氧化钠和二氧化碳反应生成碳酸钠,所以最后将变成物质D为Na2CO3;
(2)若C是红棕色气体,则C是NO2、B是NO,X为O2,图2装置是实验室制取氨气,A是NH3.
①氯化铵和氢氧化钙在加热条件下反应生成氨气;
②氨气属于碱性气体,应该用碱性或中性物质干燥;
③氨气能使湿润的红色石蕊试纸变蓝色;工业上用氨气的催化氧化得到NO.
解答 解:(1)A是一种活泼金属,C是淡黄色固体,则A为Na,X为O2,B为Na2O,C为Na2O2,过氧化钠长期露置于空气中,过氧化钠和水反应:2Na2O2+2H2O═4NaOH+O2↑,而NaOH和二氧化碳反应生成碳酸钠,过氧化钠和二氧化碳反应:2Na2O2+2CO2═2Na2CO3+O2,所以最后将变成物质D为Na2CO3;
加热时固体减少的质量是二氧化碳和水,设碳酸钠的质量是x,则碳酸氢钠的质量是(10-x)g,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 固体减少质量
168g 62g
(10-x)g (10-9.38)g
168g:62g=(10-x)g:(10-9.38)g
解得x=8.32g,
则碳酸钠的质量分数=$\frac{8.32g}{10g}$=83.2%;
故答案为:2Na2O2+2H2O═4NaOH+O2↑;Na2CO3;83.2%;
(2)若C是红棕色气体,则C是NO2、B是NO,X为O2,图2装置是实验室制取氨气,A是NH3.
①氯化铵和氢氧化钙在加热条件下反应生成氨气,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②氨气属于碱性气体,应该用碱性或中性物质干燥,所以干燥管内的干燥剂是生石灰或碱石灰,故选:bc;
③氨气能使湿润的红色石蕊试纸变蓝色,其检验方法是:将湿润的红色石蕊试纸放于试管口,试纸变蓝(或将沾有浓盐酸的玻璃棒放于试管口,产生白烟);
工业上用氨气的催化氧化得到NO,反应方程式为:4 NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:将湿润的红色石蕊试纸放于试管口,试纸变蓝(或将沾有浓盐酸的玻璃棒放于试管口,产生白烟);4 NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查了无机物推断,涉及钠、氮元素单质及其化合物的性质与转化,根据物质的颜色进行推断,熟练中学常见连续反应,掌握实验室氨气制取、干燥和收集、检验,题目难度中等.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
| A. | 图 I:反应 N2+3H 2?2NH3在恒温情况下,反应速率与压强的关系 | |
| B. | 图Ⅱ:反应 H2+I2?2HI 达平衡后,升高温度时反应速率随时间的变化 | |
| C. | 图 III:反应 CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 | |
| D. | 图 IV:反应 2SO2+O2?2SO3 达平衡后,缩小容器体积,各成分物质的量随时间的变化 |
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发性的酸 | |
| C. | 常温下,浓硫酸可以用铝罐储存,说明铝与浓硫酸不反应 | |
| D. | 在化学反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O中浓H2SO4只表现氧化性 |
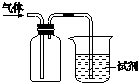
| A. | 该装置可用于收集NO2,试剂为水,用于吸收多余的NO2 | |
| B. | 若试剂是紫色石蕊试液,通入Cl2,溶液先变红后褪色,则氯气有漂白性 | |
| C. | 该装置可用于收集NH3,试剂为水,用于吸收多余的NH3 | |
| D. | 若试剂是酸性KMnO4溶液,通入SO2,溶液褪色,则得出SO2有还原性 |
| A. | Cl2通入水中 | B. | Cl2通入水Na2SO3溶液中 | ||
| C. | 二氧化硫通入氯水中 | D. | NO2通入水中 |

| A. | 1处 | B. | 2处 | C. | 3处 | D. | 4处 |
| A. | 混合气体的密度不再随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为:1:2:2 | |
| C. | 单位时间消耗0.1molX,同时生成0.2molY | |
| D. | 单位时间消耗0.1molX,同时生成0.2molZ |
| A. | 质量 | B. | 原子总数 | C. | 密度 | D. | 分子总数 |
 .
. 或
或 .
. .
.