题目内容
12.如图所示装置可用于收集气体并验证其某些化学性质,下列说法正确的是( )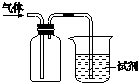
| A. | 该装置可用于收集NO2,试剂为水,用于吸收多余的NO2 | |
| B. | 若试剂是紫色石蕊试液,通入Cl2,溶液先变红后褪色,则氯气有漂白性 | |
| C. | 该装置可用于收集NH3,试剂为水,用于吸收多余的NH3 | |
| D. | 若试剂是酸性KMnO4溶液,通入SO2,溶液褪色,则得出SO2有还原性 |
分析 由实验装置可知,气体的密度比空气密度大,利用向上排空气法收集,或试剂瓶为除杂装置,结合物质的性质来解答.
解答 解:A.二氧化氮与水反应,则试剂为水,可发生倒吸,故A错误;
B.氯气不具有漂白性,氯气与水反应生成的HClO具有漂白性,故B错误;
C.氨气的密度比空气密度小,不能利用向上排空气法收集,且水为试剂可发生倒吸,故C错误;
D.SO2的密度比空气密度大,利用向上排空气法收集,且试剂为KMnO4溶液,通入SO2,发生氧化还原反应溶液褪色,则得出SO2有还原性,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质及现象为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
2.在一密闭容器中,反应aA(g)+bB(g)?mC(s)+nD(g)达到平衡,保持温度不变,将容器体积减小为原来体积的$\frac{1}{2}$,达到新的平衡时,D的浓度是原来的1.7倍,下列说法正确的是( )
| A. | 物质B的转化率增大 | B. | 平衡向正反应方向移动 | ||
| C. | 物质A的体积分数增大 | D. | a+b<m+n |
3.在饱和Ca(OH)2溶液中,加入少量CaO粉末并恢复至原温度后,下列说法正确的是( )
| A. | 溶液中Ca2+的浓度减小 | B. | 溶液质量增大 | ||
| C. | 溶液中Ca(OH)2的质量分数不变 | D. | 溶液中OH-的物质的量不变 |
20.下列说法中正确的是( )
| A. | Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 | |
| B. | 若在恒容容器中发生反应:N2+3H2?2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 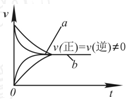 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率-时间图象可用图表示 | |
| D. | 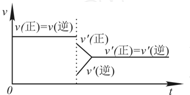 若在恒压容器中发生反应:2SO3?2SO2+O2,达到平衡后再充入适量He,其速率-时间图象可用图表示 |
7.有机反应中常用镍作催化剂,某化工厂收集的镍催化剂中含Ni 64.0%,Al 24.3%、Fe 1.4%,其余为SiO2和有机物.这些含镍废催化剂经乙醇洗涤后可按下列工艺流程回收镍:

已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:
请回答下列问题:
(1)滤液A中存在的阴离子主要是AlO2-、SiO32-、OH-.
(2)硫酸浸取滤渣a后,所得滤液B中可能含有的金属离子是Fe2+、Ni2+.
(3)滤液B中加入H2O2的目的是将Fe2+氧化成Fe3+,有利于分离.操作X的名称是蒸发浓缩、冷却结晶.
(4)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车.其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M$?_{放电}^{充电}$MHx+xNiOOH,电池充电过程中阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O,放电时负极的电极反应式为MHx+xOH--xe-=M++xH2O.

已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)滤液A中存在的阴离子主要是AlO2-、SiO32-、OH-.
(2)硫酸浸取滤渣a后,所得滤液B中可能含有的金属离子是Fe2+、Ni2+.
(3)滤液B中加入H2O2的目的是将Fe2+氧化成Fe3+,有利于分离.操作X的名称是蒸发浓缩、冷却结晶.
(4)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车.其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M$?_{放电}^{充电}$MHx+xNiOOH,电池充电过程中阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O,放电时负极的电极反应式为MHx+xOH--xe-=M++xH2O.
17.某有机物X的结构简式如图所示,则下列有关说法中正确的是( )


| A. | 有机物X的分子式为Cl2H15O | |
| B. | X分子不能使酸性高锰酸钾溶液褪色 | |
| C. | X分子中一定在同一个平面内的碳原子最多6个 | |
| D. | 在Ni作催化剂的条件下,1molX最多能与4molH2加成 |
1.氢气在氯气中燃烧,会发出( )
| A. | 苍白色火焰 | B. | 淡黄色火焰 | C. | 蓝紫色火焰 | D. | 耀眼白光 |
2.菠菜是一种富含草酸(乙二酸)的绿色蔬菜,但食用时要避免和豆腐同时食用,因为二者容易产生难溶于水的物质而在体内生成结石.草酸也是有机化工中的重要原料,广泛应用于化工生产中.为探究草酸的某些性质,某中学化学兴趣小组查阅了一些资料如下:
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物.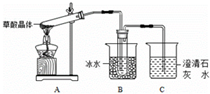
装置C中可观察到的现象是①导管口有气泡出现 ②石灰水变浑浊,由此可知草酸晶体分解的产物有CO2.装置B的主要作用是冷凝(水蒸气、草酸等),避免草酸进入装置C反应生成沉淀,干扰CO2的检验.装置C中可能发生的反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;H2C2O4+Ca(OH)2=CaC2O4↓+H2O.
(2)乙组同学认为草酸晶体分解的产物中含有CO,为了进行验证,选用甲组实验中的装置A、B和如图所示的部分装置进行实验.
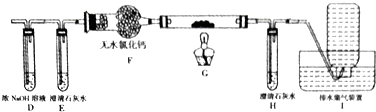
①乙组的实验装置中,装置E和H中的澄清石灰水的作用分别是验证二氧化碳是否除完和证明产物中含有一氧化碳;装置G反应管中盛有的固体物质是氧化铜(CuO);I中集气瓶收集到的气体主要是CO.
②能证明草酸晶体分解产物中有CO的现象是H中的粉末由黑色变为红色,D中澄清石灰水变浑浊.
| 物质 | 结构 | 某些性质 |
| 草酸 | 分子式:H2C2O4•2H2O | 无色,易溶于水;其钠盐和钾盐易溶于水,钙盐难溶于水 |
| 结构简式:HOOC-COOH | 熔点:101℃;升华温度:125℃;170℃以上分解 |
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物.

装置C中可观察到的现象是①导管口有气泡出现 ②石灰水变浑浊,由此可知草酸晶体分解的产物有CO2.装置B的主要作用是冷凝(水蒸气、草酸等),避免草酸进入装置C反应生成沉淀,干扰CO2的检验.装置C中可能发生的反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;H2C2O4+Ca(OH)2=CaC2O4↓+H2O.
(2)乙组同学认为草酸晶体分解的产物中含有CO,为了进行验证,选用甲组实验中的装置A、B和如图所示的部分装置进行实验.

①乙组的实验装置中,装置E和H中的澄清石灰水的作用分别是验证二氧化碳是否除完和证明产物中含有一氧化碳;装置G反应管中盛有的固体物质是氧化铜(CuO);I中集气瓶收集到的气体主要是CO.
②能证明草酸晶体分解产物中有CO的现象是H中的粉末由黑色变为红色,D中澄清石灰水变浑浊.
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C