题目内容
根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g)△H=-297.23kJ?mol-1,分析下列说法中不正确的是( )
| A、S(g)+O2(g)=SO2(g)放出热量小于297.23kJ |
| B、S(g)+O2(g)=SO2(g)放出热量大于297.23kJ |
| C、S的燃烧热为297.23kJ?mol-1 |
| D、形成1molSO2的化学键释放的总能量大于断裂1molS(s)和1molO2(g)的化学键吸收的总能量 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:由S(s)+O2(g)═SO2(g)△H=-297.23kJ/mol,可知该反应为放热反应,S(s)=S(g)为吸热过程,由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,以此来解答.
解答:
解:由S(s)+O2(g)═SO2(g)△H=-297.23kJ/mol,
A.由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,则放出的热量大于297.23 kJ,故A正确;
B.由盖斯定律可知,SO2(g)=SO2(s)为放热过程,S(s)+O2(g)═SO2(s)△H<-297.23kJ/mol,则放出的热量大于297.23 kJ,故B错误;
C.1molS的状态不知,可能是气体,也可能是固体,故C错误;
D.该反应为放热反应,则形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)的化学键所吸收的总能量,故D错误;
故选A.
A.由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,则放出的热量大于297.23 kJ,故A正确;
B.由盖斯定律可知,SO2(g)=SO2(s)为放热过程,S(s)+O2(g)═SO2(s)△H<-297.23kJ/mol,则放出的热量大于297.23 kJ,故B错误;
C.1molS的状态不知,可能是气体,也可能是固体,故C错误;
D.该反应为放热反应,则形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)的化学键所吸收的总能量,故D错误;
故选A.
点评:本题考查反应的热化学反应方程式正误判断,明确反应热与键能、盖斯定律的关系即可解答,题目难度不大.

练习册系列答案
相关题目
下列说法中不正确的是( )
| A、二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
B、结构简式为 的有机物其名称为 2-丁醇 的有机物其名称为 2-丁醇 |
| C、分子式为C4H8Br2结构中含一个一CH3的同分异构体(不考虑立体异构)有4种 |
D、某有机物球棍结构模型为: ,则该有机物能发生消去反应和氧化反应 ,则该有机物能发生消去反应和氧化反应 |
下列实验式中,没有相对分子质量就可以确定分子式的是( )
①CH3 ②CH ③CH2 ④C2H5 ⑤CH2Cl2.
①CH3 ②CH ③CH2 ④C2H5 ⑤CH2Cl2.
| A、①② | B、③④⑤ |
| C、①④⑤ | D、①③④ |
一定温度下,反应:N2(g)+3H2(g)?2NH3(g),达到化学平衡状态的标志是( )
| A、c(N2)﹕c(H2)﹕c(NH3)=1﹕3﹕2 |
| B、N2,H2和NH3的质量分数不再改变 |
| C、气体压强的压强不再改变 |
| D、单位时间内每增加1 mol N2,同时增加3 mol H2 |
下列化学方程式中,不能用离子方程式H++OH-═H2O表示的是( )
| A、2NaOH+H2SO4═Na2SO4+2H2O |
| B、Ba(OH)2+H2SO4═Ba SO4↓+2H2O |
| C、KOH+HCl═KCl+H2O |
| D、Cu(OH)2+2HNO3═Cu(NO3)2+2H2O |
下列物质:①Hg(NO3)2 ②HCHO(甲醛) ③MgSO4 ④NH4Cl ⑤KOH中,能使蛋白质变性的是( )
| A、②③④ | B、①③⑤ |
| C、①②③ | D、①②⑤ |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、l7gNH3中含有3NA个氢原子 |
| B、标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
| C、常温常压下,11.2L甲烷含有共价键数为2NA |
| D、0.lmol?L-1Na2CO3溶液中含有0.1NA个CO32- |
下列实验操作或对实验事实的描述正确的是 ( )
| A、不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 |
| B、定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容 |
| C、使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大 |
| D、用铝箔包住部分被氧化成Na2O的钠块,并用镊子夹住在水槽中反应,用倒置的量筒量取生成气体的体积,可以计算钠块中钠单质的质量分数 |
| E、用托盘天平称量11.74g氯化钠晶体 |
| F、为了使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜网包裹的锌粒 |
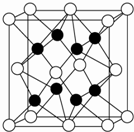 X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):