题目内容
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、l7gNH3中含有3NA个氢原子 |
| B、标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
| C、常温常压下,11.2L甲烷含有共价键数为2NA |
| D、0.lmol?L-1Na2CO3溶液中含有0.1NA个CO32- |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氨气分子中含有3个氢原子,17g氨气的物质的量为1mol,含有3mol氢原子;
B.标准状况下,四氯化碳的状态为液体,不能使用标况下的气体摩尔体积计算其物质的量;
C.常温常压下,不能使用标况下的气体摩尔体积计算甲烷的物质的量;
D.缺少碳酸钠溶液的体积,无法计算溶质碳酸钠的物质的量.
B.标准状况下,四氯化碳的状态为液体,不能使用标况下的气体摩尔体积计算其物质的量;
C.常温常压下,不能使用标况下的气体摩尔体积计算甲烷的物质的量;
D.缺少碳酸钠溶液的体积,无法计算溶质碳酸钠的物质的量.
解答:
解:A.17g氨气的物质的量为1mol,1mol氨气中含有3mol氢原子,含有3NA个氢原子,故A正确;
B.标况下四氯化碳不是气体,不能使用标况下的气体摩尔体积计算5.6L四氯化碳的物质的量,故B错误;
C.不是标况下,不能使用标况下的气体摩尔体积计算11.2L甲烷的物质的量,故C错误;
D.没有告诉碳酸钠溶液的体积,无法计算溶液中碳酸钠的物质的量,故D错误;
故选A.
B.标况下四氯化碳不是气体,不能使用标况下的气体摩尔体积计算5.6L四氯化碳的物质的量,故B错误;
C.不是标况下,不能使用标况下的气体摩尔体积计算11.2L甲烷的物质的量,故C错误;
D.没有告诉碳酸钠溶液的体积,无法计算溶液中碳酸钠的物质的量,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下四氯化碳、水、乙醇等的状态不是气体,选项D为易错点,注意缺少溶液体积,且碳酸根离子水解.

练习册系列答案
相关题目
如图实验现象预测或实验操作或实验原理正确的是( )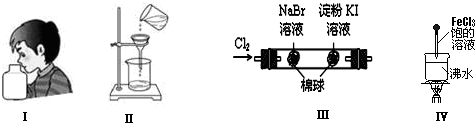

| A、实验Ⅰ:闻气味 |
| B、实验Ⅱ:过滤 |
| C、实验Ⅲ:左边的棉球呈橙色,右边的棉球呈蓝色,证明氧化性:Cl2>Br2>I2 |
| D、实验Ⅳ:当溶液至红褐色,停止加热,让光束通过体系时可产生丁达尔现象 |
下列有关物质的性质及应用说法正确的是( )
| A、过量的铜与浓硝酸反应可生成NO |
| B、Fe在O2中的燃烧产物可用于制红色涂料 |
| C、Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 |
| D、Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g)△H=-297.23kJ?mol-1,分析下列说法中不正确的是( )
| A、S(g)+O2(g)=SO2(g)放出热量小于297.23kJ |
| B、S(g)+O2(g)=SO2(g)放出热量大于297.23kJ |
| C、S的燃烧热为297.23kJ?mol-1 |
| D、形成1molSO2的化学键释放的总能量大于断裂1molS(s)和1molO2(g)的化学键吸收的总能量 |
将磁性氧化铁放入稀HNO3中可发生如下反应:Fe3O4+HNO3(稀)-Fe(NO3)3+NO↑+H2O(未配平),下列说法正确的是( )
| A、配平后的化学方程式为Fe3O4+10HNO3(稀)═3Fe(NO3)3+NO↑+5H2O |
| B、反应中每还原0.4 mol氧化剂,就有1.2 mol电子转移 |
| C、稀HNO3在反应中只表现氧化性 |
| D、磁性氧化铁中的所有铁元素全部被氧化 |
铝和铍的性质十分相似,下列关于铍性质推断正确的是( )
| A、铍能与强酸或强碱溶液起反应 |
| B、氢氧化铍可溶于水 |
| C、氯化铍溶液显碱性 |
| D、氧化铍的化学式Be2O3 |
常见金属R与硝酸银溶液反应的化学方程式为R+3AgNO3═3Ag+R(NO3)3,有关该反应的说法正确的是( )
| A、反应后溶液质量一定增加 |
| B、该金属可能是铁 |
| C、R的活泼性比Ag弱 |
| D、R表面有固体析出 |
已知化学能与其他形式的能可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是( )
A、CH4+2O2
| ||||
B、CaCO3
| ||||
C、2H2O
| ||||
D、Pb+PbO2+2H2SO4
|