题目内容
14.等物质的量的下列有机物完全燃烧,消耗O2最多的是( )| A. | C2H4 | B. | CH3CH2OH | C. | C6H6 | D. | CH3COOH |
分析 烃CxHy完全燃烧耗氧量由(x+$\frac{y}{4}$)值决定,(x+$\frac{y}{4}$)的值越大,消耗氧气的量就越多.
烃的含氧衍生物CxHyOz完全燃烧耗氧量由(x+$\frac{y}{4}$-$\frac{z}{2}$)值决定,(x+$\frac{y}{4}$-$\frac{z}{2}$)值越大,消耗氧气的量就越多.据此判断.
解答 解:A.C2H4其(x+$\frac{y}{4}$)=2+1=3,即1molC2H4消耗氧气3mol;
B.CH3CH2OH其(x+$\frac{y}{4}$-$\frac{z}{2}$)=2+1.5-0.5=3,即1molC3H6O消耗氧气3mol;
C.C6H6其(x+$\frac{y}{4}$)=6+1.5=7.5,即1molC6H6消耗氧气7.5mol;
D.CH3COOH其(x+$\frac{y}{4}$-$\frac{z}{2}$)=2+1-1=2,即1molCH3COOH消耗氧气2mol;
相同物质的量消耗氧气最多的是C6H6.
故选:C.
点评 本题考查烃及烃的含氧衍生物完全燃烧耗氧量问题,难度不大,关键清楚相同物质的量的烃CxHy完全燃烧耗氧量取决于(x+$\frac{y}{4}$),烃的含氧衍生物CxHyOz完全燃烧耗氧量由(x+$\frac{y}{4}$-$\frac{z}{2}$)值决定,注意规律的规律与总结

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 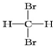 和 和 互为同分异构体 互为同分异构体 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,能说明侧链对苯环性质有影响 | |
| C. | 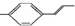 分子中所有碳原子可能都共面 分子中所有碳原子可能都共面 | |
| D. | 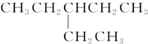 的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 |
12.下列关于Na2O2的说法正确的是( )
| A. | Na2O2与SO2反应生成Na2SO3和O2 | |
| B. | Na2O2投入到酚酞溶液中,溶液变红 | |
| C. | Na2O2与水反应,Na2O2既是氧化剂,又是还原剂 | |
| D. | Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物 |
2.某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+四种阳离子.甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:
已知:Zn2++2OH-═Zn(OH)2↓ Zn(OH)2+2OH-═ZnO${\;}_{2}^{2-}$+2H2O↓
甲:[污水]$→_{①}^{+过量NaOH溶液,过滤}$[沉淀]$→_{②}^{△}$[CuO]$→_{③}^{+H_{2},△}$[Cu]
乙:[污水]$→_{①}^{+过量铁粉,过滤}$[滤渣]$→_{②}^{△}$[CuO]$\stackrel{+H_{2},△}{→}$[Cu]
丙:[污水]$→_{①}^{+过量铁粉,过滤}$[滤渣]$→_{②}^{+稀盐酸,过滤}$[滤渣]$→_{③}^{△}$[CuO]$→_{④}^{+H_{2},△}$[Cu]
下列判断正确的是( )
已知:Zn2++2OH-═Zn(OH)2↓ Zn(OH)2+2OH-═ZnO${\;}_{2}^{2-}$+2H2O↓
甲:[污水]$→_{①}^{+过量NaOH溶液,过滤}$[沉淀]$→_{②}^{△}$[CuO]$→_{③}^{+H_{2},△}$[Cu]
乙:[污水]$→_{①}^{+过量铁粉,过滤}$[滤渣]$→_{②}^{△}$[CuO]$\stackrel{+H_{2},△}{→}$[Cu]
丙:[污水]$→_{①}^{+过量铁粉,过滤}$[滤渣]$→_{②}^{+稀盐酸,过滤}$[滤渣]$→_{③}^{△}$[CuO]$→_{④}^{+H_{2},△}$[Cu]
下列判断正确的是( )
| A. | 三种实验方案中都能制得纯净的铜 | |
| B. | 甲方案中的反应涉及置换、分解、复分解三种反应类型 | |
| C. | 乙方案中加过量铁粉只能还原其中的二种阳离子 | |
| D. | 丙方案不会产生环境污染 |
19.在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 在相同条件下,甲酸的导电性比强酸溶液的导电性弱 | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
6.下列说法正确的是( )
| A. | 最外层有两个电子的原子都是金属原子 | |
| B. | 最外层有五个电子的原子都是非金属原子 | |
| C. | 非金属元素呈现的最高化合价不超过该元素原子的最外层电子 | |
| D. | 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数 |
3.为了检验某晶体中是否含有NH4+、SO42-、Fe2+和结晶水,设计了下列操作步骤:
①取少量该晶体于试管中,加热,发现试管口处有液体,且该液体能使无水硫酸铜变蓝;
②取少量该晶体的溶液于试管中,加入KSCN溶液,没有明显的变化,滴加几滴氯水,溶液显红色;
③取少量该晶体的溶液于试管中,再加入盐酸,没有明显的变化.再加入BaCl2溶液,有白色沉淀产生;
④取少量该晶体的溶液于试管中,加入浓NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时还有白色沉淀产生,该沉淀很快变成灰绿色沉淀最终变为红褐色沉淀.下列说法正确的是( )
①取少量该晶体于试管中,加热,发现试管口处有液体,且该液体能使无水硫酸铜变蓝;
②取少量该晶体的溶液于试管中,加入KSCN溶液,没有明显的变化,滴加几滴氯水,溶液显红色;
③取少量该晶体的溶液于试管中,再加入盐酸,没有明显的变化.再加入BaCl2溶液,有白色沉淀产生;
④取少量该晶体的溶液于试管中,加入浓NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时还有白色沉淀产生,该沉淀很快变成灰绿色沉淀最终变为红褐色沉淀.下列说法正确的是( )
| A. | 实验②中发生反应的离子方程式为:Fe2++Cl2═Fe3++2Cl-;Fe3++3SCN-═Fe(SCN)3 | |
| B. | 通过上述实验可确定该化合物的化学式为:(NH4)2Fe(SO4)2•6H2O | |
| C. | 只做实验①③④,也能达到实验目的 | |
| D. | 为了检验SO42-,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |